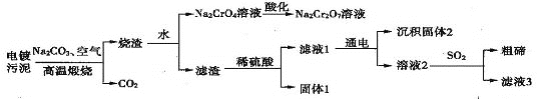
题目内容
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是4.94g
B.ClO-的生成是由于温度升高引起的
C.氧化性ClO-<ClO3-
D.反应中转移电子的物质的量是0.21mol
【答案】D
【解析】
氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故转移电子物质的量为0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,根据钾原子守恒氢氧化钾的物质的量=0.3mol,结合m=nM计算氢氧化钾质量。
A.通过以上分析知,氢氧化钾的物质的量=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故A错误;
B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故B错误;
C.根据已知条件无法判断次氯酸根离子和氯酸根离子氧化性强弱,故C错误;
D.该反应中转移电子的物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】直接排放含![]() 的气体会形成酸雨,危害环境.
的气体会形成酸雨,危害环境.
(1)在大气中![]() 形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
(2)钠碱循环法用![]() 溶液作为吸收液,可脱除烟气中
溶液作为吸收液,可脱除烟气中![]() ,吸收液吸收
,吸收液吸收![]() 的过程中,pH随
的过程中,pH随![]() :
:![]() 变化关系如下表:
变化关系如下表:
| 91:9 | 1:1 | 9:91 |
pH |
|
|
|
判断![]() 溶液显 ______ 性,用化学平衡原理解释 ______ ;
溶液显 ______ 性,用化学平衡原理解释 ______ ;
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则![]() 在阳极放电的电极反应式是 ______ ;
在阳极放电的电极反应式是 ______ ;
(4)若用烧碱溶液吸收![]() ,①向100mL
,①向100mL![]() 溶液中不断通入一定量
溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按![]()
![]() 、
、![]() ,Ⅱ.______ ,Ⅲ
,Ⅱ.______ ,Ⅲ![]() 、
、![]() ,Ⅳ.______ ;
,Ⅳ.______ ;
②若要验证白色固体X是第I种组成,依次加入的试剂为 ______ ![]() 填序号字母
填序号字母![]() .
.
![]() 盐酸
盐酸![]()
![]() 溶液
溶液![]() 溶液
溶液![]()
![]() 溶液
溶液![]() 酚酞试液
酚酞试液
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为
的溶液时其中一个反应的离子方程式为![]() ,则另一反应的离子方程式 ______ .
,则另一反应的离子方程式 ______ .