��Ŀ����
����Ŀ��ij������ຬ���ڻ���ͭ(Cu2Te)������������(Cr2O3)�Լ�������ȣ�ijС�����������Դ�ۺ����õķ�����
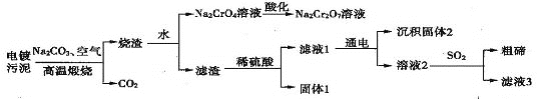
��֪���ں���λ��ͬ���壬����ʱCu2Te�����ķ�ӦΪCu2Te+2O2![]() 2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
2CuO+TeO2��������TeO2����ϡ���ᷢ���ķ�ӦΪTeO2+H2SO4====TeOSO4+H2O��
����˵���������
A. �������������������ʱͭ���ں�Ԫ�ض�������
B. ���ữ��ʱ������Һ�м�������
C. ������1������Ҫ�ɷ�ΪCu
D. ����Һ3������ѭ������
���𰸡�C
��������
A.������ຬ���ڻ���ͭ(Cu2Te)������������(Cr2O3),����ʱ������Ӧ�Ļ�ѧ����ʽΪ��3O2+Cr2O3+Na2CO3![]() 4Na2CrO4+4CO2.��Cu2Te+2O2
4Na2CrO4+4CO2.��Cu2Te+2O2![]() 2CuO+TeO2�����ݻ��ϼ۷���ͭ���ں�Ԫ�صĻ��ϼ۶������ˣ����Զ��������ˣ���A��ȷ��B. ���ữ��ʱ�����ķ�Ӧ�����ӷ���ʽΪ��CrO42-+2H+= Cr2O72-+ H2O,���Կ�����Һ�м������ᣬ��B��ȷ��C.�����к���CuO ��TeO2�ͽ𣬼����������Ӧ��CuO+ H2SO4=CuSO4+ H2O ;TeO2+ H2SO4=TeOSO4+H2O��������Ӧ�����Թ���1������Ҫ�ɷ�ΪAu,��C ����D.�ɿ�ͼ֪���Һ�г���TeOSO4��,������CuSO4;SO2��ԭTeOSO4�����������,������Һ3ΪH2SO4�����������п���ѭ�����õ�����������,��D��ȷ���𰸣�C��
2CuO+TeO2�����ݻ��ϼ۷���ͭ���ں�Ԫ�صĻ��ϼ۶������ˣ����Զ��������ˣ���A��ȷ��B. ���ữ��ʱ�����ķ�Ӧ�����ӷ���ʽΪ��CrO42-+2H+= Cr2O72-+ H2O,���Կ�����Һ�м������ᣬ��B��ȷ��C.�����к���CuO ��TeO2�ͽ𣬼����������Ӧ��CuO+ H2SO4=CuSO4+ H2O ;TeO2+ H2SO4=TeOSO4+H2O��������Ӧ�����Թ���1������Ҫ�ɷ�ΪAu,��C ����D.�ɿ�ͼ֪���Һ�г���TeOSO4��,������CuSO4;SO2��ԭTeOSO4�����������,������Һ3ΪH2SO4�����������п���ѭ�����õ�����������,��D��ȷ���𰸣�C��

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�