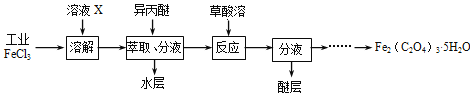
题目内容
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态Ga原子价电子排布式______,核外电子占据最高能级的电子云形状为______;基态As原子最高能层上有______个电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为______和+3,砷的第一电离能比镓______(填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为______。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为______,AsH3分子的空间构型为______。
(5)相同压强下,AsH3的沸点______NH3(填“大于”或“小于”),原因为______。
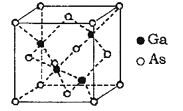
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以______(填“共价键”或“离子键”)键合。设阿伏伽德罗常数的值为NA,该晶胞边长为a pm则GaAs晶体的密度为______gcm-3(列出计算式即可)。
【答案】4s24p1 哑铃型 3 +1 大 V、Co sp3 三角锥形 大于 NH3分子之间含氢键 共价键 ρ=![]()
【解析】
(1)Ga是31号元素,基态Ga原子价电子排布式为4s24p1,核外电子占据最高能级的电子云形状为哑铃型,As为33号元素,基态As原子最高能层上有3个电子,故答案为:4s24p1;哑铃型;3;
(2)根据镓的电离能数值可知,失去1个电子或3个电子时电离能突变,由此可推知镓的主要化合价为+1和+3,砷的4p上有3个电子,为半充满状态,所以砷第一电离能比镓大,故答案为:+1;大;
(3)As原子核外有3个未成对电子,在第四周期中,与之相同的元素符为V,其价电子排布式为3d34s2和Co,其价电子排布式为3d74s2,故答案为:V、Co;
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的价层电子对数为4,杂化方式为sp3,由于As和N同主族,化学性质相似,所以NH3是三角锥形,AsH3也是三角锥形,故答案为:sp3;三角锥形;
(5)As和N同主族,相同压强下,AsH3的沸点小于NH3的沸点,因为NH3分子之间含氢键,沸点反常高于同主族的氢化物的沸点,故答案为:大于;NH3分子之间含氢键;
(6)GaAs为原子晶体,Ga与As以共价键键合,该晶胞中Ga原子个数为4,As原子个数为8×1/8+6×1/2=4,该晶胞的密度为ρ=![]() =
=![]() ,故答案为:共价键;ρ=
,故答案为:共价键;ρ=![]() 。
。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案