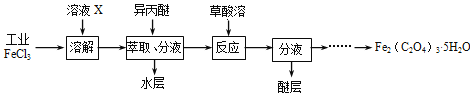
题目内容
【题目】直接排放含![]() 的气体会形成酸雨,危害环境.
的气体会形成酸雨,危害环境.
(1)在大气中![]() 形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
形成硫酸型酸雨有二种途径,写出任一途径反应的化学方程式 ______ ;
(2)钠碱循环法用![]() 溶液作为吸收液,可脱除烟气中
溶液作为吸收液,可脱除烟气中![]() ,吸收液吸收
,吸收液吸收![]() 的过程中,pH随
的过程中,pH随![]() :
:![]() 变化关系如下表:
变化关系如下表:
| 91:9 | 1:1 | 9:91 |
pH |
|
|
|
判断![]() 溶液显 ______ 性,用化学平衡原理解释 ______ ;
溶液显 ______ 性,用化学平衡原理解释 ______ ;
(3)当吸收液的pH降至约为6时,送至电解槽中,电解槽的阳极室中是稀硫酸,则![]() 在阳极放电的电极反应式是 ______ ;
在阳极放电的电极反应式是 ______ ;
(4)若用烧碱溶液吸收![]() ,①向100mL
,①向100mL![]() 溶液中不断通入一定量
溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按![]()
![]() 、
、![]() ,Ⅱ.______ ,Ⅲ
,Ⅱ.______ ,Ⅲ![]() 、
、![]() ,Ⅳ.______ ;
,Ⅳ.______ ;
②若要验证白色固体X是第I种组成,依次加入的试剂为 ______ ![]() 填序号字母
填序号字母![]() .
.
![]() 盐酸
盐酸![]()
![]() 溶液
溶液![]() 溶液
溶液![]()
![]() 溶液
溶液![]() 酚酞试液
酚酞试液
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为
的溶液时其中一个反应的离子方程式为![]() ,则另一反应的离子方程式 ______ .
,则另一反应的离子方程式 ______ .
【答案】![]() 、
、![]() 酸性
酸性 ![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度
的电离程度大于水解程度 ![]()
![]()
![]() cb
cb ![]()
【解析】
(1)根据二氧化硫的性质及酸雨形成原理分析解答;(2)根据题给信息中pH判断溶液酸碱性,并用平衡移动原理分析;(3)根据电解原理分析电极反应式;(4)①由于![]() 和NaOH反应时物质的量之比不同则产物不同,故可根据
和NaOH反应时物质的量之比不同则产物不同,故可根据![]() 和NaOH反应时物质的量之比对产物进行讨论;②根据离子检验原理分析解答;(5)根据氧化还原反应原理分析解答。
和NaOH反应时物质的量之比对产物进行讨论;②根据离子检验原理分析解答;(5)根据氧化还原反应原理分析解答。
(1)在大气中![]() 形成硫酸型酸雨有二种途径,其中一种途径为:
形成硫酸型酸雨有二种途径,其中一种途径为:![]() 、
、![]() , 故答案为:
, 故答案为:![]() 、
、![]() ;
;
(2)由于![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度,故答案为:酸性;
的电离程度大于水解程度,故答案为:酸性;![]() 在溶液中存在如下两平衡:
在溶液中存在如下两平衡:![]() 、
、![]() ,由表中数据可知,当
,由表中数据可知,当![]() :
:![]() :91时,溶液中主要存在
:91时,溶液中主要存在![]() ,此时
,此时![]() 溶液显酸性,证明
溶液显酸性,证明![]() 的电离程度大于水解程度;
的电离程度大于水解程度;
(3)当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:![]() , 故答案为:
, 故答案为:![]() ;
;
(4)由反应方程式![]() ①、
①、![]() ②可知
②可知
![]() :
:![]() 时产物为
时产物为![]() ,
,![]() :
:![]() 时产物为
时产物为![]() ,
,
所以![]() :
:![]() 时,NaOH过量则产物为
时,NaOH过量则产物为![]() ;
;![]() :
:![]() 时,对于①反应来说二氧化硫过量而对于②反应来说二氧化硫的量不足,所以产物为
时,对于①反应来说二氧化硫过量而对于②反应来说二氧化硫的量不足,所以产物为![]() ;
; ![]() :
:![]() 时,二氧化硫过量,则固体产物为
时,二氧化硫过量,则固体产物为![]() ,向100mL
,向100mL ![]() 烧碱溶液中不断通入一定量
烧碱溶液中不断通入一定量![]() 充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、
充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是:NaOH、![]() ;
;![]() ;
;![]() 、
、![]() ;
;![]() ; 故答案为:
; 故答案为:![]() ;
; ![]() ;
;
②验证白色固体X是第I种组成NaOH、![]() ,需要验证亚硫酸根离子和氢氧根离子,可以先加入
,需要验证亚硫酸根离子和氢氧根离子,可以先加入![]() 溶液检验亚硫酸根离子,后加入
溶液检验亚硫酸根离子,后加入![]()
![]() 溶液检验氢氧化钠,或先加入过量
溶液检验氢氧化钠,或先加入过量![]() 溶液检验亚硫酸钠,然后加入
溶液检验亚硫酸钠,然后加入![]() 酚酞试液检验氢氧化钠, 故答案为:
酚酞试液检验氢氧化钠, 故答案为:![]() 或
或![]() ;
;
(5)常温下将![]() 转化为
转化为![]() 而实现
而实现![]() 的处理.含
的处理.含![]() 的废气通入含
的废气通入含![]() 、
、![]() 的溶液时其中一个反应的离子方程式为:
的溶液时其中一个反应的离子方程式为:![]() ,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:
,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() 。
。