题目内容
【题目】常温下,浓度均为0.1mol/L、体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH与lg(V/V0)的变化关系如图所示。下列说法正确的是
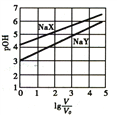
A. Kh(NaY)=10-6
B. HX、HY都是弱酸,且Ka(HX)<Ka(HY)
C. lg(V/V0)=3时,NaX溶液中所含离子总数大于NaY溶液
D. 向稀释前的两溶液中分别加盐酸至pH=7时,c(X-)=c(Y-)
【答案】C
【解析】已知NaY溶液的pOH=3,c(OH-)=10-3mol/L,c(HY) c(OH-),c(Y-)0.1 mol/L,所以NaY的水解平衡常数Kh(NaY)= c(OH-)×c(HY)/c(Y-)10-5,A错误;NaX、NaY溶液pOH≠7,说明NaX、NaY溶液发生水解,所以HX、HY都是弱酸,浓度均为0.1mol/L、体积均为V0的NaX、NaY溶液,pH分别4和3,说明水解程度NaX<NaY,所以Ka(HX)>Ka(HY),B错误; 根据电荷守恒:NaX溶液中c(Na+)+c(H+)=c(OH-)+c(X-);NaY溶液:c(Na+)+c(H+)=c(OH-)+ c(Y-);lg(V/V0)=3时,溶液稀释1000倍时,NaX水解能力小于NaY的水解能力,所以c(OH-):NaX小于NaY,所以c(H+):NaX大于NaY,所以NaX溶液中所含离子总数大于NaY溶液,C正确;向稀释前的两溶液中分别加盐酸至pH=7时,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(X-)+ c(Cl-);c(Na+)+c(H+)=c(OH-)+ c(Y-)+ c(Cl-);由于c(H+)=c(OH-),所以c(Na+)= c(X-)+ c(Cl-),c(Y-)+ c(Cl-)= c(Na+),由于NaX溶液中pOH较大,加入盐酸的量就少,c(Cl-)较少,所以c(X-)> c(Y-),D错误;正确选项C。

【题目】今有下列各组反应,放出H2的平均速率最快的是(不考虑酸根对速率的影响)( )。
编号 | 金属 | 酸的浓度及体积 | 反应温度/℃ |
A | 2.4 g镁条 | 3 mol·L-1硫酸100 mL | 30 |
B | 2.4 g镁粉 | 3 mol·L-1盐酸200 mL | 40 |
C | 2.4 g镁粉 | 3 mol·L-1硫酸100 mL | 40 |
D | 5.6 g铁粉 | 3 mol·L-1硫酸100 mL | 40 |
A.AB.BC.CD.D
【题目】已知:![]()
利用如图装置用正丁醇合成正丁醛![]() 相关数据如表:
相关数据如表:
物质 | 沸点 | 密度 | 水中溶解性 |
正丁醇 |
|
| 微溶 |
正丁醛 |
|
| 微溶 |
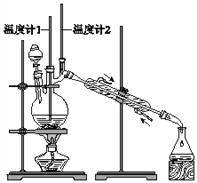
下列说法中,不正确的是![]()
A. 为防止产物进一步氧化,应将酸化的![]() 溶液逐滴加入正丁醇中
溶液逐滴加入正丁醇中
B. 当温度计1示数为![]() ,温度计2示数在
,温度计2示数在![]() 左右时,收集产物
左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 向获得的粗正丁醛中加入氢氧化钠后再蒸馏,可进一步除去粗产品中的正丁醇杂质