题目内容
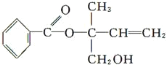
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:___。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团为:___、__。
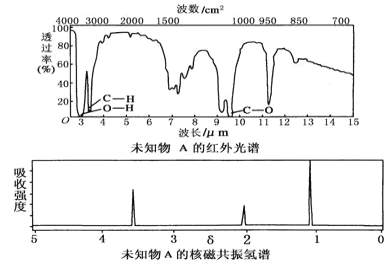
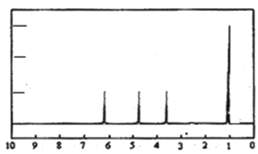
(4)A的核磁共振氢谱如图:则A中含有___种氢原子。
(5)综上所述,A的结构简式为___,跟NaHCO3溶液反应的离子方程式为___。
【答案】90 C3H6O3 —COOH —OH 4  CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑
CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑
【解析】
(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90;
(2)9.0g物质A的物质的量为0.1mol;浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量为:![]() =0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:
=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:![]() =0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是
=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是![]() =3,即分子式为:C3H6O3;
=3,即分子式为:C3H6O3;
(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,0.1molA可生成2.24LCO2(标准状况)即0.1mol二氧化碳,则含有一个-COOH;
醇羟基和羧基可以和金属钠发生反应生成氢气,0.1molA与足量金属钠反应生成2.24LH2(标准状况)即0.1mol氢气,且已知含有一个羧基,则还含有一个-OH;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种环境的氢原子;
(5)综上所述A的结构简式为 ;与碳酸氢钠反应生成二氧化碳和水以及相应的钠盐,离子方程式为:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。
;与碳酸氢钠反应生成二氧化碳和水以及相应的钠盐,离子方程式为:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
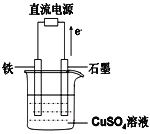
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。