题目内容
11.按要求填空(1)下列物质:①Fe ②CO2 ③H2O ④KOH ⑤NH4Cl ⑥H2SO4 ⑦酒精 其中属于电解质的有③④⑤⑥(用序号作答).
(2)在一定条件下,21.6gA单质与1.20molCl2完全反应,生成0.800molAClx,则x=3,A的摩尔质量为27g•mol-1.
(3)分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)实验方法是蒸馏.
(4)用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑(用化学方程式表示).
分析 (1)在水溶液里或熔融状态下导电的化合物是电解质,包括:酸、碱、盐、金属氧化物、水;
(2)根据A的质量和A的物质的量计算出A的摩尔质量,根据氯原子质量守恒,1.20molCl2完全反应,生成0.800molAClx,可以计算出x;
(3)根据沸点不同,用蒸馏的方法分离乙酸和乙酸乙酯;
(4)根据自来水一般都是通入氯气消毒,氯气和水反应生成盐酸和次氯酸:Cl2+H2O?HCl+HClO,次氯酸见光分解.
解答 解:(1)解:①Fe是单质,既不是电解质,也不是非电解质;
②CO2是非金属氧化物,属于非电解质;
③H2O是氧的氢化物,属于电解质;
④KOH是碱,属于电解质;
⑤NH4Cl是盐,属于电解质;
⑥H2SO4是酸,属于电解质;
⑦C2H5OH(酒精)水溶液和熔融状态下都不导电的化合物,属于非电解质;
所以属于电解质的有:③④⑤⑥;故答案为:③④⑤⑥;
(2)根据质量守恒,0.800molAClx中含有0.800molA和0.800xmolCl,
所以1.20molCl2中含有2.4molCl,即0.800xmol=2.4,解得x=3,
21.6gA的物质的量为0.800mol,A的摩尔质量为:$\frac{21.6g}{0.800mol}$=27g/mol,
故答案为;3;27g/mol;
(3)乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)的沸点不同,可用蒸馏的方法进行分离;故答案为:蒸馏;
(4)自来水在Cl2消毒中发生反应:Cl2+H2O=HCl+HClO,次氯酸见光分解,放在阳光里晒一下就是为了将次氯酸分解使盐酸挥发出去,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑以免将金鱼致死,
故答案为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查了摩尔质量的简单计算,题目难度中等,解题关键是理解质量守恒定律的含义,要求学生熟练掌握物质的量与摩尔质量的转化关系,试题针对性强,有利于激发学生的学习兴趣和学习积极性.

 优加精卷系列答案
优加精卷系列答案| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| A. | 乙酸乙酯、甲苯、十一烷 | B. | 乙醇、苯、庚烯 | ||
| C. | 甘油、甲醛、硝基苯 | D. | 溴苯、四氯化碳、苯磺酸钠 |
| A. | CH3OH | B. | CH3CH2OH | C. | 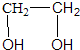 | D. | 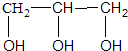 |
①用滴管吸取水样,然后用精密pH试纸测其pH
②将水样分成3份
③用同样的方法测定另2份水样
④用滴管吸取水样,然后用广泛pH试纸测其pH
正确的实验顺序为( )
| A. | ②④③① | B. | ②④①③ | C. | ②①④③ | D. | ④②①③ |
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 锌片插入硝酸银溶液中Zn+Ag+═Zn2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+═BaSO4↓ |
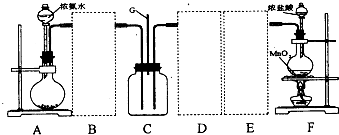
| I | Ii | Iii | |
| 备选装置 |  | 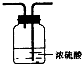 |  |
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.
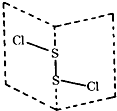
| A. | S2Cl2的分子中各原子最外层都为8电子结构 | |
| B. | S2Cl2是氧化剂,水是还原剂 | |
| C. | 将反应后所得的溶液滴入碳酸氢钠溶液中有气泡产生 | |
| D. | 反应中,生成1mol气体,转移电子为2mol |
 ,反应类型:取代反应.
,反应类型:取代反应.