题目内容
19.写出下列化学方程式,并注明反应类型(1)溴乙烷与氢氧化钠的醇溶液在加热条件下反应CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,反应类型:消去反应.
(2)苯酚与溴水的反应
 ,反应类型:取代反应.
,反应类型:取代反应.
分析 (1)有机物中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键或苯环状)化合物的反应,叫做消去反应,溴乙烷和氢氧化钠醇溶液共热生成乙烯和溴化钠,水,属于消去反应;
(2)苯酚与溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代.
解答 解:(1)卤代烃在氢氧化钠的醇溶液中发生消去反应,溴乙烷与氢氧化钠的乙醇溶液反应生成乙烯,反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,属于消去反应,
故答案为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,消去反应;
(2)苯酚与浓溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代反应的化学方程式为: ,
,
故答案为: ; 取代反应.
; 取代反应.
点评 本题考查有机反应方程式的书写和基本反应类型,明确发生的化学反应原理是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
10.草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
【实验Ⅰ】
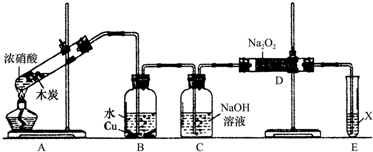
探究草酸的不稳定性.用下图中提供的仪器和试剂,验证草酸受热分解得到的混合气体中含有CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用).
(1)仪器装置正确连接顺序为:ABDCEB.
(2)用上图入提供的装置和试剂实验时,在B中观察到有白色沉淀,也不能说明草酸分解有CO2,请提也改进意见在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
【实验Ⅱ】
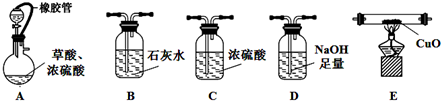
实验室用硝酸氧化淀粉水解液法制备草酸.装置如下图所示,反应原理为:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
实验步骤如下:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,蒸发浓缩、冷却结晶,抽滤后再重结晶得到草酸晶体
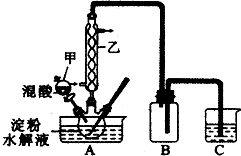
(3)上图实验装置中仪器乙的名称为:冷凝管、装置B的作用安全瓶,防止倒吸、C中试剂是NaOH溶液.
(4)检验淀粉是否水解完全的操作及现像是:取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全.
【实验Ⅲ】
制备草酸亚铁晶体(FeC2O4•2H2O).反应原理为:
FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O
实验步骤如下:
①称取13.7g FeSO4•(NH4)2SO4•6H2O放在200mL烧杯中,然后加30mL蒸馏水和2mL 2mol•L-1 H2SO4,加热溶解.
②再加入40mL 1mol•L-1草酸溶液,加热至沸,然后迅速搅拌(防止暴沸),待有黄色晶体析出后,停止加热,静置.
③弃去上层清液,用40mL蒸馏水充分洗涤晶体,过滤后,再用丙酮洗涤晶体并晾干得4.6g FeC2O4•2H2O
(5)生成的FeC2O4•2H2O需要充分洗涤,检验是否洗涤干净的操作及现像是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(6)用丙酮洗涤晶体的目的是减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分.
(7)本实验FeC2O4•2H2O的产率为73.1%.
| 物质 | 物理性质 | 化学性质 |
| 草酸(H2C2O4) | ①易溶于水 ②熔点189.5℃、100℃开始升华 ③草酸钙和草酸氢钙均是白色不溶物 | ①二元弱酸、酸性比碳酸强 ②有毒、具有腐蚀性 ③157℃左右分解、与浓硫酸混合会产生H2O、CO和CO2 |
| 草酸亚铁晶体(FeC2O4•2H2O) | ①浅黄色粉末状晶体 ②微溶于水,难溶于丙酮 | 受热易分解为氧化亚铁或铁单质 |
| 丙酮 | 与水互溶、易挥发 | ---- |
探究草酸的不稳定性.用下图中提供的仪器和试剂,验证草酸受热分解得到的混合气体中含有CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用).

(1)仪器装置正确连接顺序为:ABDCEB.
(2)用上图入提供的装置和试剂实验时,在B中观察到有白色沉淀,也不能说明草酸分解有CO2,请提也改进意见在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
【实验Ⅱ】
实验室用硝酸氧化淀粉水解液法制备草酸.装置如下图所示,反应原理为:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
实验步骤如下:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,蒸发浓缩、冷却结晶,抽滤后再重结晶得到草酸晶体

(3)上图实验装置中仪器乙的名称为:冷凝管、装置B的作用安全瓶,防止倒吸、C中试剂是NaOH溶液.
(4)检验淀粉是否水解完全的操作及现像是:取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全.
【实验Ⅲ】
制备草酸亚铁晶体(FeC2O4•2H2O).反应原理为:
FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O
实验步骤如下:
①称取13.7g FeSO4•(NH4)2SO4•6H2O放在200mL烧杯中,然后加30mL蒸馏水和2mL 2mol•L-1 H2SO4,加热溶解.
②再加入40mL 1mol•L-1草酸溶液,加热至沸,然后迅速搅拌(防止暴沸),待有黄色晶体析出后,停止加热,静置.
③弃去上层清液,用40mL蒸馏水充分洗涤晶体,过滤后,再用丙酮洗涤晶体并晾干得4.6g FeC2O4•2H2O
(5)生成的FeC2O4•2H2O需要充分洗涤,检验是否洗涤干净的操作及现像是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(6)用丙酮洗涤晶体的目的是减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分.
(7)本实验FeC2O4•2H2O的产率为73.1%.
7.在①硫酸②重晶石③三氧化硫④绿矾四种化合物中,硫元素的质量分数由高到底排列的顺序是( )
| A. | ①>②>③>④ | B. | ②>③>④>① | C. | ①>③>②>④ | D. | ③>①>②>④ |
14.下列物质属于单质的是( )
| A. | CH4 | B. | NaCl | C. | H2SO4 | D. | O2 |
4.标准状况下,10mL某气态烃,在足量的氧气中完全燃烧,得到40mLCO2,则该烃可能是( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
9.把一套以液化石油气(主要成分为C3H8和C4H10)为燃料的炉灶,现改用天然气(主要成分为CH4)为燃料,需要调整进入炉灶的燃料和空气的量.正确方法为( )
| A. | 只需调大燃料气的进气量 | B. | 只需调大空气的进气量 | ||
| C. | 同时调大燃料气和空气的量 | D. | 同时调小燃料气和空气的量 |