��Ŀ����
����Ŀ�����жԻ�ѧ��Ӧ�����˵������ȷ����
A.ͬһ���ʵĹ̡�Һ��������״̬����ֵ�ݼ�
B.�����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s�����Է����У�����H<0
C.CaCO3(s)=CaO(s)+CO2(g����H>0����S>0�������ں��������¶��������Է�
D.��Ϊ�ʱ���ر䶼�뷴Ӧ���Է����йأ�����ʱ���ʱ�����Ե�����Ϊ�жϷ�Ӧ�ܷ��Է����е��о�
���𰸡�B
��������
A. ͬһ���ʵĹ̡�Һ��������״̬����ֵ������A�����
B. �����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s) ��S��0�����Է�������Ҫ����Ϊ��H<0��B����ȷ��
C. CaCO3(s)=CaO(s)+CO2(g����H>0����S>0�������������оݿ�֪�����Է����У���![]() ���������¿��Է����У�C�����
���������¿��Է����У�C�����
D. �ʱ���ر䶼�뷴Ӧ���Է����йأ����ʱ���ʱ䵥����Ϊ�жϷ�Ӧ�ܷ��Է����е��о���Ƭ��ģ�Ӧ���ø����оݣ���![]() ���ۺ��жϣ�D�����
���ۺ��жϣ�D�����
��ѡB��
��ѧ��Ӧ�ܷ��Է����У�ȡ�����ʱ���ر���ۺ��оݣ���![]() ʱ����Ӧ���Է����С�
ʱ����Ӧ���Է����С�

����Ŀ��I����Ӧ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g��![]() Fe��s��+CO2��g��H<0����1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮
Fe��s��+CO2��g��H<0����1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮
��1��CO��ƽ��ת����= ______ ��
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ�� ______
a����߷�Ӧ�¶� b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ��� d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
II����1����¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״��� CO��g��+2H2��g��CH3OH��g���������ͼʾ�ش��������⣺
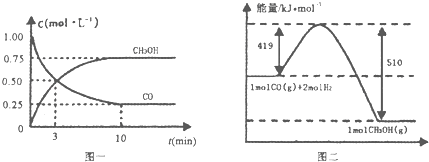
��1���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��= ______ ��
��2�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
�� | 1molCO��2molH2 | a1 | c1 | �ų�Q1kJ���� |
�� | 1molCH3OH | a2 | c2 | ����Q2kJ���� |
�� | 2molCO��4molH2 | a3 | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� ______ ��
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E �÷�Ӧ������1molCH3OH����ų���Q1+Q2��kJ������
����Ŀ��(1)2017���п�Ժij�о��Ŷ�ͨ�����һ������Na-Fe3O4/HZSM-5��ܸ��ϴ������ɹ�ʵ����CO2ֱ�Ӽ�����ȡ����ֵ���ͣ����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
��֪��H2(g)+1/2O2(g)=H2O(l) ��H1 = ��aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ��H2= ��bKJ/mol
��д��25����101kPa�����£�CO2��H2��Ӧ��������(��C8H18��ʾ)���Ȼ�ѧ����ʽ_________________________________��
(2)����CO2��H2Ϊԭ�ϣ��ں��ʵĴ���(��Cu/ZnO����)�����£�Ҳ�ɺϳ�CH3OH���漰�ķ�Ӧ�У�
�ף�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
�ң�CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
��CO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
�����CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ��___________(��д����)��
�۴����ͷ�Ӧ��ϵ�Ĺ�ϵ��������Կ�Ĺ�ϵһ�������и߶ȵ�ѡ���ԡ���������ʵ�飬����CO2��H2��ʼͶ�ϱȾ�Ϊ1��2.2��������ͬ��Ӧʱ��(t1min)��
�¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) | �ۺ�ѡ�� |
543 | Cu/ZnO���װ����� | 12.3 | 42.3 | A |
543 | Cu/ZnO����Ƭ���� | 11.9 | 72.7 | B |
553 | Cu/ZnO���װ����� | 15.3 | 39.1 | C |
553 | Cu/ZnO����Ƭ���� | 12.0 | 70.6 | D |
�ɱ����е����ݿ�֪����ͬ�¶��²�ͬ�Ĵ�����CO2��ת��ΪCH3OH��ѡ����������Ӱ�죬�����ϱ��������ݽ�Ϸ�Ӧԭ������������ѡ��Ϊ___________(����ĸ����)��
(3)��CO��H2Ϊԭ�Ϻϳ��״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
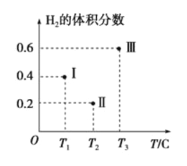
��0��5minʱ��������������CH3OH��ʾ�Ļ�ѧ��Ӧ����Ϊ_________________��
������������һ���ﵽƽ��״̬��������________(��д��������)��