题目内容
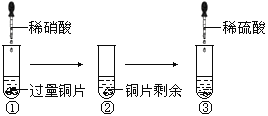
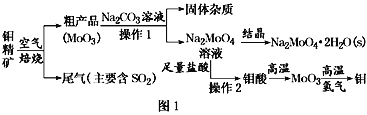
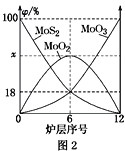
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。

(1)实验开始前,首先进行的操作是___;
(2)实验室制各乙炔的方程式为___;
(3)仪器A在安装前必须进行的操作是___,为防止气体生成的速率过快,由A滴入B的试剂为___。
(4)装置C可选用的试剂为___(写出一种即可),其作用为___;
(5)反应开始后,D中的现象为___,所发生反应的反应类型为___;
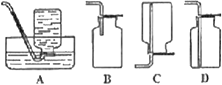
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
【答案】检查装置的气密性 CaC2+2H2O![]() Ca(OH)2+C2H2↑ 检查分液漏斗是否漏液 饱和食盐水 NaOH溶液或CuSO4溶液 除去气体中的杂质 溴水褪色 加成反应 A
Ca(OH)2+C2H2↑ 检查分液漏斗是否漏液 饱和食盐水 NaOH溶液或CuSO4溶液 除去气体中的杂质 溴水褪色 加成反应 A
【解析】
实验室中为缓解此反应的速率,常用饱和食盐水代替水反应制取,碳化钙CaC2与水反应生成氢氧化钙和乙炔,方程式为:CaC2+2H2O ![]() Ca(OH)2+C2H2↑,乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜反应生成硫化铜沉淀;乙炔中含有碳碳三键,与溴发生加成反应。
Ca(OH)2+C2H2↑,乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜反应生成硫化铜沉淀;乙炔中含有碳碳三键,与溴发生加成反应。
(1)反应前要检查装置的气密性;
(2) 碳化钙CaC2与水反应生成氢氧化钙和乙炔,方程式为:CaC2+2H2O ![]() Ca(OH)2+C2H2↑;
Ca(OH)2+C2H2↑;
(3)安装分液漏斗前要检查分液漏斗是否漏液,实验室中为缓解此反应的速率,常用饱和食盐水代替水反应制取;
(4)乙炔中常混有杂质气体硫化氢等,硫化氢与硫酸铜或反应生成硫化铜沉淀,或者和NaOH溶液反应;
(5)乙炔中含有碳碳三键,与溴发生加成反应,溴水褪色;
(6)乙炔不溶于水,乙炔相对分子质量26,与空气29接近,因此不宜使用排空气法,最好用排水法收集。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.在![]() 内,Ⅰ中M的分解速率为
内,Ⅰ中M的分解速率为![]()
B.水样酸性越强,M的分解速率越快
C.在![]() 内,Ⅲ中M的分解百分率比Ⅱ大
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于![]() 存在,Ⅳ中M的分解速率比Ⅰ快
存在,Ⅳ中M的分解速率比Ⅰ快