题目内容
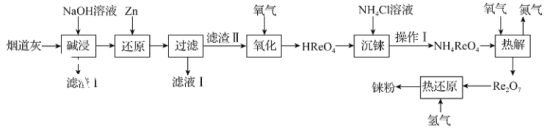
【题目】铼(Re)是熔点和沸点较高的金属单质之一,用于制造高效能喷射引擎和火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有SiO2、Re2O7、MoO3、CuO、Fe3O4)中提取铼粉的流程如图:
已知:
I.过铼酸(HReO4)是易溶于水的一元强酸,但不具有强氧化性。
II.过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)“碱浸”时,Re2O7和MoO3与NaOH发生以下反应:Re2O7+2NaOH=2NaReO4+H2O;MoO3+2NaOH=Na2MoO4+H2O,则“滤渣I”的成分为___。
(2)①“还原”时,Zn被氧化成ZnO![]() ,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
,NaReO4被还原生成难溶的2ReO2·2H2O,该反应的离子方程式为___。
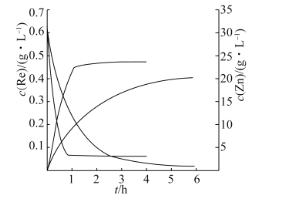
②分别在20℃和60℃条件下进行“还原”时,溶液中Re和Zn的含量变化如图中曲线所示,若不考虑时间对还原反应的影响,“还原”时,最好选择的温度为___。
(3)通氧气进行“氧化”时,往往进行加压,目的是___。“氧化”时,若生成376.5g过铼酸,理论上消耗标准状况下氧气的体积为___ L。
(4)“沉铼”时,加入热NH4Cl溶液至产生白色沉淀,为使沉淀充分析出并分离得到纯净NH4ReO4晶体,“操作I”包括___、洗涤、干燥。
(5)为提高铼的纯度,“过滤”得到的NH4ReO4需进行提纯,提纯所用的方法是___。
(6)“热解”时,发生反应的化学方程式为___。
【答案】CuO、Fe3O4 3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2·2H2O 20℃ 增大氧气在溶液中的溶解度,加快氧化速率 25.2 冷却结晶、过滤 重结晶 4NH3ReO4+3O2
+2ReO2·2H2O 20℃ 增大氧气在溶液中的溶解度,加快氧化速率 25.2 冷却结晶、过滤 重结晶 4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7
2N2+8H2O+2Re2O7
【解析】
烟道灰经过NaOH溶液碱浸后,SiO2、Re2O7、MoO3发生反应,滤渣1中是CuO、Fe3O4。加Zn还原,发生反应3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2+2H2O,过滤后得到ReO2·2H2O固体,经O2氧化后得到过铼酸(HReO4)。加入热NH4Cl溶液,经过冷却结晶、过滤、洗涤、干燥得到过铼酸铵(NH4ReO4),再与O2发生反应4NH3ReO4+3O2
+2ReO2+2H2O,过滤后得到ReO2·2H2O固体,经O2氧化后得到过铼酸(HReO4)。加入热NH4Cl溶液,经过冷却结晶、过滤、洗涤、干燥得到过铼酸铵(NH4ReO4),再与O2发生反应4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7,得到Re2O7,最后用H2还原氧化物得到金属Re。
2N2+8H2O+2Re2O7,得到Re2O7,最后用H2还原氧化物得到金属Re。
(1)“碱浸”时,Re2O7和MoO3与NaOH发生反应:Re2O7+2NaOH=2NaReO4+H2O;MoO3+2NaOH=Na2MoO4+H2O,SiO2与NaOH发生反应:SiO2+2NaOH=Na2SiO3+H2O,只有CuO、Fe3O4没有反应,故滤渣1是CuO、Fe3O4;
(2)①根据题意,Zn被氧化成ZnO![]() ,NaReO4被还原生成ReO2·2H2O,故离子方程式是3Zn+2ReO
,NaReO4被还原生成ReO2·2H2O,故离子方程式是3Zn+2ReO![]() +4OH-=3ZnO
+4OH-=3ZnO![]() +2ReO2·2H2O;
+2ReO2·2H2O;
②温度越高,反应速率越快,由图像可知,两条比较陡的曲线为60℃时的曲线,稍微缓和的曲线是20℃时的曲线。20℃的曲线最后的Re含量低,即得到的固体更多,不考虑时间因素,选择20℃;
(3)气体的溶解度随压强的增大而增大,加压可以增大氧气在溶液中的溶解度,即加大了O2的浓度,从而加快氧化速率;376.5g过铼酸的物质的量为![]() ,Re元素由ReO2中的+4价变为HReO4中的+7价,每个Re转移电子数为3,所以共转移电子
,Re元素由ReO2中的+4价变为HReO4中的+7价,每个Re转移电子数为3,所以共转移电子![]() ,每个O2转移4个电子,O2的物质的量为
,每个O2转移4个电子,O2的物质的量为![]() ,体积为
,体积为![]() ;(4)由分析可知,加入热NH4Cl溶液后需经冷却结晶、过滤操作;
;(4)由分析可知,加入热NH4Cl溶液后需经冷却结晶、过滤操作;
(5)过铼酸铵(NH4ReO4)是白色片状晶体,微溶于冷水,溶于热水,提纯时可用热水溶解后冷却结晶,属于重结晶;
(6)由分析可知,NH3ReO4与O2反应生成N2和Re2O7,反应方程式为4NH3ReO4+3O2![]() 2N2+8H2O+2Re2O7;
2N2+8H2O+2Re2O7;