题目内容
【题目】I.反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= ______ 。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 ______
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: CO(g)+2H2(g)CH3OH(g)。请根据图示回答下列问题:
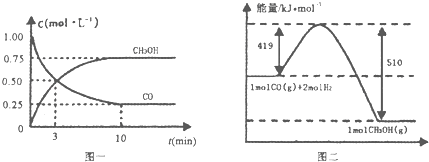
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ______ 。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | a2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是 ______ .
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E 该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量。
【答案】60% d 0.15mol/(Lmin) ADE
【解析】
I.(1)由平衡常数和起始浓度根据三段法进行基本计算;
(2)a.该反应为放热反应,升高温度,平衡逆移;
b.该反应为等体积反应,增大压强,平衡不移动;
c.选择合适的催化剂,平衡不移动;
d.移出部分CO2,使其浓度减小,平衡正移;
e.粉碎矿石,增大了接触面积,平衡不移动;
II.(1)由图一可知CO的变化量为0.75mol/L,甲醇的变化量为0.75 mol/L,可计算得到H2的变化量,进一步计算反应速率;
(2)甲装置投入1molCO和2molH2与乙装置投入1molCH3OH等效,达到平衡时c1=c2,丙容器中的投入量是甲容器投入量的2倍,但两容器的平衡也等效,据此回答问题。
I.(1)设CO的转化了x mol
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
始(mol) 1 1
转(mol) x x
平(mol) 1-x 1+x
平衡常数等于4.0,那么K= ,解得x=0.6mol
,解得x=0.6mol
CO的平衡转化率=![]() ;
;
(2)a.该反应为放热反应,升高温度,平衡逆移,a项错误;
b. 该反应为等体积反应,增大压强,平衡不移动,转化率不变,b项错误;
c. 选择合适的催化剂,反应速率加快,但平衡不移动,转化率不变,c项错误;
d. 移出部分CO2,使其浓度减小,平衡正移,转化率增大,d项正确;
e. 粉碎矿石,增大了接触面积,平衡不移动,转化率不变,e项错误;
答案选d;
II.(1))由图一可知CO的变化量为0.75mol/L,甲醇的变化量为0.75 mol/L,可计算得到H2的变化量为1.5 mol/L,那么v=![]() 0.15molL-1min-1;
0.15molL-1min-1;
(2)A.甲装置投入1molCO和2molH2与乙装置投入1molCH3OH等效,达到平衡时c1=c2,A项正确;
B.丙容器中的投入量是甲容器投入量的2倍,甲、丙两容器中的平衡为等效平衡,但相当于增大了压强,平衡正移,则2Q1<Q3,B项错误;
C.甲、丙两容器中的平衡为等效平衡,增大了压强,平衡正移,则有a1<a3,C项错误;
D.甲、乙、丙三容器中的平衡均等效,则有a1+a2=1,D项正确;
E. 甲、乙两容器中的平衡等效,由于方向相反,若生成1molCH3OH,则放出(Q1+Q2)kJ热量;
答案选ADE。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.在![]() 内,Ⅰ中M的分解速率为
内,Ⅰ中M的分解速率为![]()
B.水样酸性越强,M的分解速率越快
C.在![]() 内,Ⅲ中M的分解百分率比Ⅱ大
内,Ⅲ中M的分解百分率比Ⅱ大
D.由于![]() 存在,Ⅳ中M的分解速率比Ⅰ快
存在,Ⅳ中M的分解速率比Ⅰ快