题目内容
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
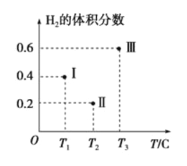
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
【答案】8CO2(g)+25H2(g)=C8H18(1)+16H2O(1) ΔH=—(25a-b)KJ/mol K=![]() 小于 降低温度、减小产物浓度 B 0.0875mol/(L·min) Ⅲ
小于 降低温度、减小产物浓度 B 0.0875mol/(L·min) Ⅲ
【解析】
(1)已知:①H2(g)+1/2O2(g)=H2O(l) ΔH1 =—aKJ/mol;
②C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2=—bKJ/mol
根据盖斯定律,由①×25-②得反应方程式:8CO2(g)+25H2(g)=C8H18(1) +16H2O(1) ΔH=25ΔH1-ΔH2=ΔH=—(25a-b)KJ/mol;
(2) ①已知甲:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-53.7 kJ·mol-1平衡常数K1
CH3OH(g)+H2O(g)△H=-53.7 kJ·mol-1平衡常数K1
乙:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.2 kJ·mol-1平衡常数K2;根据盖斯定律,由甲-乙得反应CO(g)+2H2(g)
CO(g)+H2O(g)△H=+41.2 kJ·mol-1平衡常数K2;根据盖斯定律,由甲-乙得反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=![]() ;△H=-53.7 kJ·mol-1-41.2 kJ·mol-1=-94.9 kJ·mol-1<0;②反应CO(g)+2H2(g)
;△H=-53.7 kJ·mol-1-41.2 kJ·mol-1=-94.9 kJ·mol-1<0;②反应CO(g)+2H2(g) ![]() CH3OH(g)是气体体积缩小的放热反应,提高CO2转化为CH3OH平衡转化率的措施有降低温度、减少产物浓度、按比例充入原料CO2和H2等;③由表中数据分析在相同温度下不同催化剂对甲醇的选择性有显著影响,使用Cu/ZnO纳米片催化剂时甲醇选择性高;使用相同的催化剂在不同温度下,虽然二氧化碳的转化率增加,甲醇的选择性却减小,说明温度升高,副产物增加,因此综合考虑选B选项;
CH3OH(g)是气体体积缩小的放热反应,提高CO2转化为CH3OH平衡转化率的措施有降低温度、减少产物浓度、按比例充入原料CO2和H2等;③由表中数据分析在相同温度下不同催化剂对甲醇的选择性有显著影响,使用Cu/ZnO纳米片催化剂时甲醇选择性高;使用相同的催化剂在不同温度下,虽然二氧化碳的转化率增加,甲醇的选择性却减小,说明温度升高,副产物增加,因此综合考虑选B选项;
(3) ①CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始时的物质的量:1 2 0
转化的物质的量: a 2a a
平衡时的物质的量:1-a 2-2a a
容器Ⅱ中0~5 min内H2含量是20%,a=![]() ,v(CH3OH)= 0.0875mol/(L·min);②Ⅲ中温度高氢气含量高,说明达到平衡升高温度平衡逆向移动,氢气含量增加。
,v(CH3OH)= 0.0875mol/(L·min);②Ⅲ中温度高氢气含量高,说明达到平衡升高温度平衡逆向移动,氢气含量增加。