题目内容
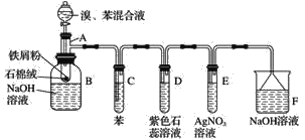
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
【答案】![]() +Br2
+Br2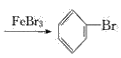 +HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
+HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
【解析】
由实验装置可知,A中苯与液溴发生取代反应生成溴苯、HBr,B中溴苯与NaOH溶液分层,且溴苯在下层,C中苯可除去挥发的溴,D中HBr使紫色石蕊变红,E中HBr与硝酸银反应生成淡黄色AgBr沉淀,F中NaOH可吸收尾气,倒扣的漏斗可防止倒吸,以此来解答。
(1)铁屑和溴发生反应:2Fe+3Br2=2FeBr3,生成的FeBr3作催化剂,使苯和液溴发生反应,化学方程式为![]()
(2)苯和液溴的反应是放热反应,且溴易挥发,挥发出来的溴蒸气对实验产生干扰,必须除去,可以利用溴易溶于有机物来除溴,因此试管C中苯的作用是除去HBr中混有的溴蒸气;HBr溶液显酸性,紫色石蕊溶液遇酸变红;AgNO3溶液与HBr发生反应:AgNO3+HBr=AgBr↓+HNO3,试管E中有淡黄色沉淀生成。
(3)纯净的溴苯为无色液体,因溶有溴而呈褐色,因此B中NaOH溶液的作用是除去溴苯中的溴,便于观察溴苯的颜色;溴苯是难溶于水、且密度比水的密度大的液体,故在溶液的底部可以观察到无色油状液体;
(4)在上述整套装置中,D、E中导管口均在液面上,F中有倒扣的漏斗刚好没入液面,则具有防倒吸的装置有D、E、F。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:___;
(2)该反应的正反应为__反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是__(填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___。