题目内容
【题目】煤燃烧产生的烟气中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO![]() (aq)+H2O(l) k1
(aq)+H2O(l) k1
②ClO-(aq)+SO![]() (aq)=SO
(aq)=SO![]() (aq)+Cl-(aq) k2
(aq)+Cl-(aq) k2
③CaSO4(s)=Ca2+(aq)+SO![]() (aq) k3
(aq) k3
k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=___(用k1、k2、k3表示)。
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡___。
②已知饱和溶液中的SO2有![]() 与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
(3)SO2的水溶液中存在歧化反应:3SO2+2H2O=2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2Ob:I2+2H2O+SO2=SO42-+2I-+4H+
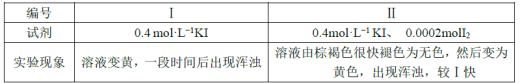
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
完成下列问题:
①由实验现象可得出反应a与反应b的速率:v(a)___v(b)(填“>”“﹤”或“=”)。
②测得反应3SO2+2H2O=2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示___(填物质的名称)的变化。该反应在实验Ⅰ条件下进行,15min时达到化学平衡状态,用SO2表示该反应前15min内的平均反应速率为___mol·L-1·min-1。

③下列叙述能说明3SO2(aq)+2H2O(l)=2H2SO4(aq)+S(s)反应已达到平衡状态的是____填字母)。
A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
【答案】![]() H2SO3
H2SO3![]() H++HSO
H++HSO![]() 、HSO
、HSO![]()
![]() H++SO
H++SO![]() 、H2O
、H2O![]() H++OH- 1.8×10-2molL-1 < 硫 0.03 BCD
H++OH- 1.8×10-2molL-1 < 硫 0.03 BCD
【解析】
(1)根据盖斯定律进行计算;
(2)①把SO2通入11.2mL水中制得饱和溶液,生成H2SO3,为二元弱酸,水也为弱电解质,也能电离;
②根据Ka1=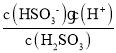 计算;
计算;
(3)①由实验现象可知,同时加入KI和碘单质时出现浑浊的速度不只加入KI要快;
②由图可知,N的物质的量增大,则N是生成物,15min共生成0.003molN,同时消耗0.015mol-0.006mol=0.009molM,可以推知反应速率v(M)=3v(N),由方程式3SO2+2H2O![]() 2H2SO4+S↓可以推知;
2H2SO4+S↓可以推知;
③根据反应达到平衡的标准判断;
(1)①SO2(g)+2OH-(aq)=![]() (aq)+H2O(l) k1;②ClO-(aq)+
(aq)+H2O(l) k1;②ClO-(aq)+![]() (aq)=
(aq)=![]() (aq)+Cl-(aq) k2;③CaSO4(s)
(aq)+Cl-(aq) k2;③CaSO4(s)![]() Ca2+(aq)+
Ca2+(aq)+![]() (aq) k3;①+②-③可得SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq),k1=
(aq) k3;①+②-③可得SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq),k1=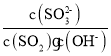 ,k2=
,k2= ,k3=
,k3=![]() ,K=
,K=![]() ;
;
(2)①把SO2通入11.2mL水中制得饱和溶液,生成H2SO3,该溶液中存在的电离平衡有:H2SO3![]() HSO3-+H+、HSO3-
HSO3-+H+、HSO3-![]()
![]() + H+、H2O
+ H+、H2O![]() H++OH-;
H++OH-;
②根据题意可知,11.2mL水中溶解的二氧化硫的体积为11.2![]() 67.2×10-3L=0.75L,标况下物质的量浓度为
67.2×10-3L=0.75L,标况下物质的量浓度为 =2.989mol/L,饱和二氧化硫溶液中H2SO3的浓度为2.989mol/L
=2.989mol/L,饱和二氧化硫溶液中H2SO3的浓度为2.989mol/L![]()
![]() =1.993mol/L,pH=0.74,则c(H+)=0.18mol/L,
=1.993mol/L,pH=0.74,则c(H+)=0.18mol/L,

H2SO3的第一步电离Ka1=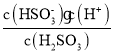 mol/L =
mol/L =![]() =1.8
=1.8![]() 10-2mol/L;
10-2mol/L;
(3)①由实验现象可知,同时加入KI和碘单质时出现浑浊的速度不只加入KI要快,故v(a)﹤v(b);
②由图可知,N的物质的量增大,则N是生成物,15min共生成0.003molN,同时消耗0.015mol-0.006mol=0.009molM,可以推知反应速率v(M)=3v(N),由方程式3SO2+2H2O![]() 2H2SO4+S↓可知,M为SO2,N为硫;用SO2表示该反应前15min内的平均反应速率为v(SO2)=
2H2SO4+S↓可知,M为SO2,N为硫;用SO2表示该反应前15min内的平均反应速率为v(SO2)=![]() =
=![]() =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
③A.生成1.5molSO2的同时消耗1molH2SO4描述的都是逆反应的速率,不能说明反应达到平衡,A错误;
B.3SO2(aq)+2H2O(l)![]() 2H2SO4(aq)+S(s)可以看成是分子数减小的反应,当溶液中的分子总数不再变化时,说明反应到达平衡,B正确;
2H2SO4(aq)+S(s)可以看成是分子数减小的反应,当溶液中的分子总数不再变化时,说明反应到达平衡,B正确;
C.恒温恒容时,混合溶液中硫酸的密度保持不变说明硫酸的物质的量不变,说明说明反应到达平衡,C正确;
D.温度不变,化学平衡常数不变,所以反应的化学平衡常数不再变化时,说明反应放热和吸热相等,说明反应到达平衡,D正确;
答案为BCD。

 阅读快车系列答案
阅读快车系列答案