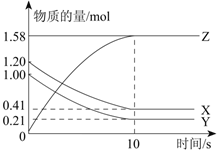
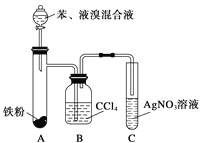
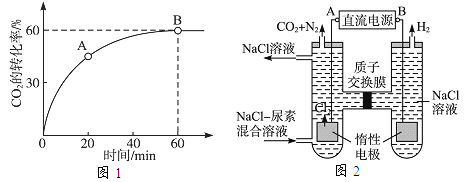
题目内容
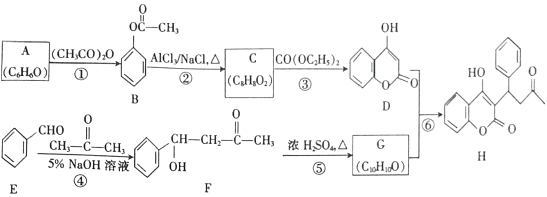
【题目】(10分)根据下列变化关系:

请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
【答案】C6H12O6 NaOH溶液 中和稀H2SO4 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH
2CH3CHO+2H2O 氧化反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化(取代)反应
CH3COOCH2CH3+H2O 酯化(取代)反应
【解析】
根据题中各物质转化关系及有关现象可知,淀粉在酸性条件下水解得葡萄糖,所以A为葡萄糖,在混合溶液中加过量的氢氧化钠溶液将溶液调成碱性,再加新制的氢氧化铜悬浊液,加热出现砖红色沉淀,所以B为氢氧化钠溶液,C为新制的氢氧化铜悬浊液,葡萄糖在酒化酶的作用下得D为CH3CH2OH,D发生氧化反应得乙醛,乙醛氧化得乙酸,乙酸与乙醇反应生成E为CH3COOCH2CH3,据此判断。
(1)根据上面的分析可知,A为葡萄糖,分子式为C6H12O6,B溶液为NaOH溶液,作用是中和稀硫酸,将溶液调成碱性;
(2)反应④为乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型为氧化反应;反应⑥为乙醇和乙酸的酯化反应,方程式为CH3COOH+CH3CH2OH
2CH3CHO+2H2O,反应类型为氧化反应;反应⑥为乙醇和乙酸的酯化反应,方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,反应类型为酯化(取代)反应;
CH3COOCH2CH3+H2O,反应类型为酯化(取代)反应;

练习册系列答案
相关题目