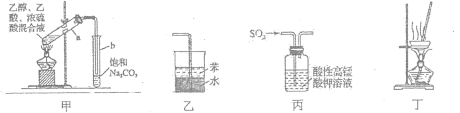
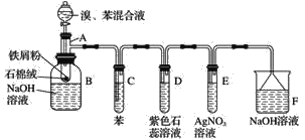
题目内容
【题目】在![]() 和
和![]() 的混合液中先加入过量的KI溶液,再加入足量
的混合液中先加入过量的KI溶液,再加入足量![]() 溶液,最后所得沉淀是( )
溶液,最后所得沉淀是( )
A.![]() 、
、![]() B.
B.![]() 、
、![]()
C.![]() 、
、![]() D.FeS、
D.FeS、![]() 、S
、S
【答案】D
【解析】
加入碘离子后,将铁离子全部还原成亚铁离子,同时生成碘单质;
加入硫化钠,碘将氧化硫离子生成硫沉淀;
硫化钠水解,所以溶液中有硫离子和氢氧根离子,
根据题目中的提示,显然亚铁离子结合硫离子,铝离子结合氢氧根离子,
所以还生成硫化亚铁沉淀和氢氧化铝沉淀.
在FeCl3和AlCl3溶液中加过量KI,先是FeCl3与KI两盐发生氧化还原反应:2Fe3++2I-=2Fe2++I2,反应完后溶液中含大量Fe2+、Al3+、I2,
再加入Na2S后,硫离子水解S2-+H2O![]() HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,Fe2++S2-=FeS↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,或理解为Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl;
HS-+OH-.在Na2S溶液中,有大量S2-、OH-,依题意知,Fe2+结合S2-能力强,两盐发生复分解反应,形成FeS沉淀,Fe2++S2-=FeS↓;Al3+结合OH-能力强,形成Al(OH)3沉淀,Al3++3OH-=Al(OH)3↓,或理解为Al3+与S2-发生双水解反应:3Na2S+AlCl3+6H2O=2Al(OH)3↓+3H2S↑+6NaCl;
又因I2的存在发生:I2+S2-=S↓+2I-或I2+H2S=S↓+2HI,所以最终得到的沉淀是FeS、Al(OH)3和S的混合物。
故选:D。

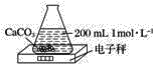
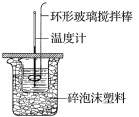
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___。
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=___(结果保留一位小数)。
(4)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__。