题目内容
2.黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①2Cu2O+Cu2S→6Cu+SO2…②.则( )| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
分析 反应2Cu2S+3O2→2Cu2O+2SO2中,Cu元素化合价不变,S元素化合价升高,O元素化合价降低,反应2Cu2O+Cu2S→6Cu+SO2中,Cu元素化合价降低,S元素化合价升高,以此解答该题.
解答 解:A.反应①中只有O元素化合价降低,则Cu2O、SO2都为还原产物,故A错误;
B.氧化、还原反应同时进行,反应2Cu2O+Cu2S→6Cu+SO2中,Cu元素化合价降低,S元素化合价升高,发生氧化还原反应,故B错误;
C.将1 molCu2S冶炼成 2mol Cu,最终产物为Cu和SO2,由质量守恒可知生成1molSO2,需要O21mol,故C正确;
D.若1molCu2S完全转化为2molCu,最终产物为Cu和SO2,总方程式为Cu2S+O2→2Cu+SO2,反应中Cu元素化合价降低,S元素化合价升高,转移电子的物质的量为6mol,则转移电子数为6NA,故D错误.
故选C.
点评 本题考查金属的冶炼以及氧化还原有关知识,为高频考点,侧重学生的分析、计算能力的考查,题目难度不大,注意分析各元素的化合价的变化特点,以正确分析氧化剂和还原剂.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
13.下列说法正确的是( )
| A. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| B. | 将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应可得到NH3分子数为NA | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
10.可确定乙二醇分子是否有极性的实验是( )
| A. | 测定沸点 | B. | 测静电对液流影响 | ||
| C. | 测定蒸气密度 | D. | 测标准状况下气体摩尔体积 |
17.在化学能与电能的转化中,下列叙述正确的是( )
| A. | 镀锌铁皮在食盐水中发生析氢腐蚀 | |
| B. | 电解池的阴极材料一定比阳极材料活泼 | |
| C. | 将铁器与电源正极相连,可在其表面镀锌 | |
| D. | 原电池的负极和电解池的阳极均发生氧化反应 |
7.在酸性Fe(NO3)3溶液中逐渐通入H2S气体,可能发生的离子反应是( )
| A. | H2S+2NO3-+2H+=2NO2↑+S↓+2H2O | |
| B. | 3 H2S+2NO3-+2H+=2NO↑+3S↓+4H2O | |
| C. | 3Fe3++3NO3-+6H2S=3NO↑+6S↓+3Fe2++6H2O | |
| D. | Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O |
11.设NA代表阿伏加德罗常数的数值,下列说法中正确的是;( )
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,16gO2和O3的混合气体中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4LO2 混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
12.下列说法正确的是( )
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 | |
| D. | 室温下,浓度均为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
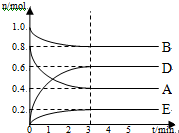 某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.
某温度T℃下,在某个固定容积为2.0L的密闭容器内,在时按右图所示发生反应:其中A、B、D为气体,E为固体.