题目内容
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
【答案】升温、搅拌、适当增大硫酸浓度、粉碎矿石 TiO2++2H2O=H2TiO3↓+2H+ ![]() 温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗
温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗 ![]()
【解析】
根据流程:用硫酸酸浸钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质),SiO2不溶,钛酸亚铁、氧化镁溶解,过滤,滤渣1为SiO2,滤液1含有Fe2+、TiO2+、Mg2+,水解滤液1发生反应:TiO2++2H2O=H2TiO3↓+2H+,过滤得到H2TiO3,煅烧H2TiO3得到TiO2,电解得到Ti;滤液2主要含有Fe2+、Mg2+,加入碳酸氢铵沉铁反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到FeCO3沉淀和含有Mg2+的滤液3,FeCO3与氧气煅烧得到铁红,据此分析作答。
(1)适当升温。搅拌、适当增大六三浓度、粉碎矿石等可以提高浸取速度和浸取率;
(2)根据分析,滤液1含有TiO2+,水解生成H2TiO3,离子反应为:TiO2++2H2O=H2TiO3↓+2H+;
(3)“沉铁”过程中生成的气体是二氧化碳,其电子式为![]() ;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
(4)已知:Ksp[Mg(OH)2]=1.0×10-11,使Mg2+恰好沉淀完全,此时c(OH-)= ![]() mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒,阳极反应为:2O2--4e-=O2↑,阳极产生的氧气与石墨反应生成二氧化碳,导致阳极损耗,故阳极石墨棒需要定期更换;
(6)铁红溶于稀硫酸得到Fe3+,与KI发生反应:2Fe3++2I-=2Fe2++I2,用硫代硫酸钠(Na2S2O3)标准液滴定生成的碘,有关系式:Fe2O3~2Fe3+~I2~2Na2S2O3,则n(Fe2O3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() cV×10-3mol,故mg样品中铁红产品的纯度为
cV×10-3mol,故mg样品中铁红产品的纯度为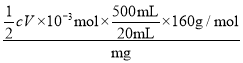 ×100%=
×100%=![]() 。
。







