题目内容
【题目】X、Y、Z为三种短周期元素,在元素周期表中,X的原子半径最小,Z的非金属性最强。又知,Y原子的最外层电子数比次外层电子数多4个,X、Y能形成甲、乙两种化合物,乙中X和Y的原子个数比为1:1。
(1)X、Y、Z的元素符号为:X _____Y ________Z_________;
(2)甲中存在的化学键类型为________________________;
(3)Z的原子结构示意图为___________________________;
(4)向甲和乙的混合物中加入少量MnO2,发生反应的化学方程式为____________________________________________________________。
【答案】H O F 共价键  2H2O2
2H2O2![]() 2H2O+ O2↑
2H2O+ O2↑
【解析】
X、Y、Z三种短周期元素,X原子半径是所有元素中最小的,则X为H元素;Y的最外层电子数比次外层多4个电子,Y原子只能有2个电子层,最外层电子数为6,则Y为O元素;X、Y能形成甲、乙两种化合物,分别为H2O和H2O2,其中乙中X和Y的原子个数比为1:1,则乙为H2O2,Z的非金属性最强,则Z为F元素,据此分析解答。
根据上述分析,X为H元素,Y为O元素,Z为F元素,甲为H2O,乙为H2O2;
(1)由上述分析可知,X为H、Y为O、Z为F;
(2)由上述分析可知,甲为H2O,为共价化合物,含有共价键;
(3)Z为F元素,原子结构示意图为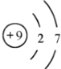 ;
;
(4)向甲和乙的混合物中加入少量MnO2,过氧化氢分解生成水和氧气,发生反应的化学方程式为2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目