��Ŀ����
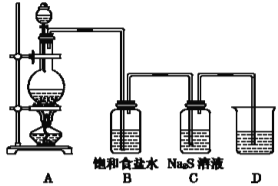
����Ŀ����ȩ��֬��1907�������ϵ�һ���ϳɵĸ߷��Ӳ��ϡ������÷��ࣨ�籽�ӣ���ȩ�ࣨ���ȩ��������Ĵ�������϶��ɵġ���ͼ��ʵ������ȡ��ȩ��֬��װ��ͼ����ʵ�����ô���ΪŨ���ᣩ������˵���������

A.װ���в������ܵ���������������
B.�Թ��з����ķ�Ӧ�ǣ�
C.���Ʊ�ʵ�������ȡ���Թܣ���ȴ�����£����������Ҵ��������ȣ������ܽ⣬˵�������������Ƶõķ�ȩ��֬Ϊ��״�ṹ
D.ʵ����Ϻ����Թ���ˮ����ϴ�ӣ����Լ��������Ҵ����ݼ����ӣ�Ȼ��ϴ��
���𰸡�C
��������
A����Ӧ�д����ȷų������ӡ���ȩ��Һ�ӷ�����Ӧװ���еij������ܳ������⣬���ԶԻӷ��ķ�Ӧ���������������ã�A��ȷ��
B�������ǻ���λ�ϵ�������ԭ�ӱȽϻ��ã����ȩȩ���ϵ���ԭ�ӽ��Ϊˮ���ӣ����ಿ������������Ϊ�߷��ӻ�����--��ȩ��֬����Ӧ�ķ���ʽ���Ա�ʾΪ��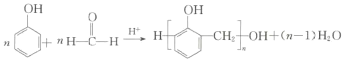 ��B��ȷ��
��B��ȷ��
C���������ȩ��Ӧ���ɷ�ȩ��֬������������ͽṹ���ڼ��������״�ṹ��C����
D��ʵ�������ñ��ӹ����������������������������Ը߷�����֬�����þƾ�����һЩʱ�������ˮϴ����D��ȷ��
��ѡC��

 �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�����Ŀ�������Ͷ�����̼��һ�������¿ɺϳɼ״���CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��
CH3OH(g)+H2O(g)��
I���ں��������£��ֱ�2 molCO2��6 mol H2����һ���̶��ݻ�Ϊ1L���ܱ������У����ŷ�Ӧ�Ľ��У�����������n(H2)��n(CH3OH)�뷴Ӧʱ��t�Ĺ�ϵ���±�;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n��H2��/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n��CH3OH��/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)ǰ10min������CO2��ʾ�ķ�Ӧ����Ϊ____________��
(2)���¶��£��˷�Ӧ��ƽ�ⳣ��K=__________��
(3)���¶��£�����ͬ�ݻ�����һ������Ͷ��ģ�CO2��H2��CH3OH��H2O��Ũ�ȷֱ�Ϊ2 mol��L-1��2 mol��L-1��1 mol��L-1��1 mol��L-1�����ʱv��_______v��(���������������=��)��
�����ܱ������г���1molCO2��3 mol H2����û�������м״�������������¶ȵĹ�ϵ��ͼA��ʾ��
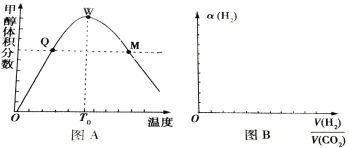
�Իش��������⣺
(1)�÷�Ӧ��______(����ȡ������ȡ�)��Ӧ��
(2)������Q���ת����_________(����ڡ�����С�ڡ����ڡ�����ͬ)������W���ת���ʣ�
(3)����0��T0�ڣ��״�����������仯���ƣ�_______________��
(4)ͼB��ʾ����ת������(H2)��Ͷ�ϱ�![]() �Ĺ�ϵ������ͼB�л��������仯���߲�������߶�Ӧ���������������߶�Ӧ�������ֱ�Ϊ��һ�����߶�Ӧ��ѹǿ��1.01��105Pa����һ�����߶�Ӧ��ѹǿ��3.03��105Pa(����������ͬ)________��
�Ĺ�ϵ������ͼB�л��������仯���߲�������߶�Ӧ���������������߶�Ӧ�������ֱ�Ϊ��һ�����߶�Ӧ��ѹǿ��1.01��105Pa����һ�����߶�Ӧ��ѹǿ��3.03��105Pa(����������ͬ)________��