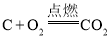题目内容
【题目】下列实验操作规范并能达到实验目的的是
实验操作 | 实验目的 | |
A | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
B | 用玻璃管蘸取待测液,点在干燥的pH试纸中部,片刻后与标准比色卡比较读数 | 粗略测定NaClO溶液pH |
C | 用0.1 mol/LMgSO4溶液滴入到2mlNaOH溶液中至不再有沉淀生成再滴入0.1 mol/LCuSO4溶液 | 比较Mg(OH)2和Cu(OH)2的Ksp大小 |
D | 向亚硫酸钠溶液中滴加硝酸钡和硝酸 | 检验亚硫酸钠溶液是否变质 |
A.AB.BC.CD.D
【答案】C
【解析】
A.除去乙烷中的乙烯不能用氢气,因为会引入氢气这种新的杂质气体,故A错误;
B.由于![]() 溶液具有强氧化性,能使pH试纸褪色,故不能测定
溶液具有强氧化性,能使pH试纸褪色,故不能测定![]() 溶液pH,故B错误;
溶液pH,故B错误;
C.![]() 和
和![]() 组成相似,溶度积常数较小的物质转化为溶度积更小的物质,用
组成相似,溶度积常数较小的物质转化为溶度积更小的物质,用![]() 溶液滴入到2 mL NaOH溶液中至不再有沉淀生成,则
溶液滴入到2 mL NaOH溶液中至不再有沉淀生成,则![]() 完全反应生成
完全反应生成![]() ,再滴入
,再滴入![]() 溶液,若产生蓝色沉淀,则证明
溶液,若产生蓝色沉淀,则证明![]() 转化为
转化为![]() ,则说明
,则说明![]() 的
的![]() 比
比![]() 的
的![]() 小,故C正确;
小,故C正确;
D. 亚硫酸钠具有还原性,![]() 能被硝酸氧化为
能被硝酸氧化为![]() ,
,![]() 与
与![]() 反应生成
反应生成![]() 白色沉淀,不能检验出亚硫酸钠溶液是否变质,故D错误;
白色沉淀,不能检验出亚硫酸钠溶液是否变质,故D错误;
故答案为:C。

【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
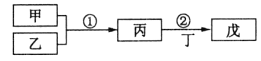
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是___酸(填强或弱)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式___。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
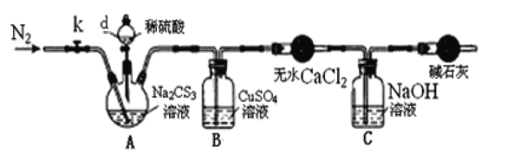
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是___。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为___。(保留1位小数)