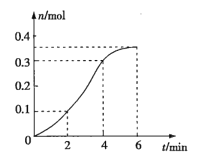
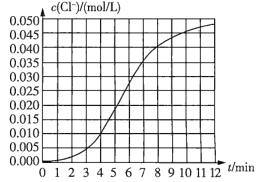
题目内容
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
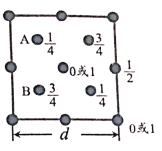
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
【答案】2 ![]() O或氧 1个3s 3个3p
O或氧 1个3s 3个3p ![]()
![]() 低
低 ![]() 是一种空间网状的共价晶体,共价键结合较为牢固
是一种空间网状的共价晶体,共价键结合较为牢固 ![]()
【解析】
⑴根据化合物中各元素的化合价代数和为零来计算n值,Cu2+ 的价电子排布式根据铜原子的价电子排布式3d104s1 得出。
⑵“中国蓝”中![]() 、Si都不存在孤对电子,而O原子中存在孤对电子。
、Si都不存在孤对电子,而O原子中存在孤对电子。
⑶SiO2是空间网状结构,一个Si原子周围连有4个O原子。Si原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子。而杂化轨道用于形成σ键和容纳孤对电子。所以SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成。
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根。
⑸碳酸根中C提供4个电子,O不提供电子,加两个负电荷,6个电子形成3对电子,属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,
,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,![]() 比
比![]() 稳定。
稳定。
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() 。
。
⑴根据化合物中所有元素化合价代数和为0可计算出Cu的化合价为+2,故Cun+离子中n=2,Cu的价电子排布式3d104s1,当失去2个电子时价电子排布式变为![]() ,故答案为2,
,故答案为2,![]() ;
;
⑵“中国蓝”中![]() ,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
⑶SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成,故答案为:1个3s,3个3p;
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根,所以钡矿化学式是![]() ,故答案为:
,故答案为:![]() ;
;
⑸碳酸根中C属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属碳酸盐的热稳定性
,对于碱土金属碳酸盐的热稳定性![]() 比
比![]() 稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:
稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:![]() ,低;
,低;
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() ,故答案为:
,故答案为:![]() 是一种空间网状的原子晶体,共价键结合较为牢固,
是一种空间网状的原子晶体,共价键结合较为牢固,![]() ;
;

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】下列实验操作规范并能达到实验目的的是
实验操作 | 实验目的 | |
A | 在一定条件下,向混有少量乙烯的乙烷中通入氢气 | 除去乙烷中的乙烯 |
B | 用玻璃管蘸取待测液,点在干燥的pH试纸中部,片刻后与标准比色卡比较读数 | 粗略测定NaClO溶液pH |
C | 用0.1 mol/LMgSO4溶液滴入到2mlNaOH溶液中至不再有沉淀生成再滴入0.1 mol/LCuSO4溶液 | 比较Mg(OH)2和Cu(OH)2的Ksp大小 |
D | 向亚硫酸钠溶液中滴加硝酸钡和硝酸 | 检验亚硫酸钠溶液是否变质 |
A.AB.BC.CD.D
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
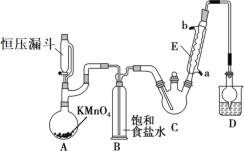
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-