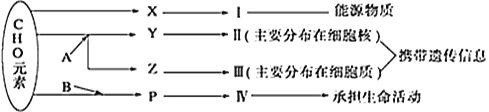
题目内容
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和O2。下列说法中正确的是

A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,电极Y与外接直流电源的负极相连
C. 该电池放电时,每转移4 mol电子,理论上生成1mol C
D. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
【答案】C
【解析】A、电池放电时,CO2转变成C和LiCO3过程中,CO2中+4价C元素得到电子化合价降低,3CO2+4e-+4Li+=C+2Li2CO3,该反应发生在原电池正极既电极Y,负极X:Li-e-=Li-, 因此Li+向Y电极移动,A错误。B、充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和O2,在此过程中,O元素失去电子从-2价变成0价,2Li2CO3-4e-=4Li++2CO2↑+O2↑,因此Y为阳极,连接电源正极,B错误。C、由上述A的电极反应可以得到,当电路中转移4 mol电子时正极有1mol C生成,C正确。D、由上述B可得D错误。正确答案C。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。