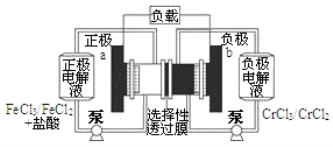
��Ŀ����
����Ŀ����������ʾ�����İ����������ڳ����¿ɺϳ�����ɰ(��Ҫ�ɷ�ΪNH4Cl)��ijʵ��С��Ը÷�Ӧ����̽������������ɰ����Ԫ�زⶨ���ش��������⣺
(1)����ɰ���Ʊ�
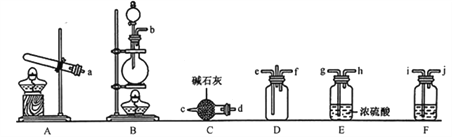
������װ��A��ȡʵ������İ�����д����Ӧ�Ļ�ѧ����ʽ��_______________________��
�ڸ�ʵ������Ũ������MnO2��Ӧ��ȡ������������װ�DF�е��Լ���_______________(��д�Լ�����)��
��Ϊ��ʹ������������D�г�ֻ�ϣ���ȷ������װ�õĺ�������˳��________��-ef��_________(��Сд��ĸ�ͼ�ͷ��ʾ����ͷ��������������һ��)��
��֤��������������Ӧ������ɰ���ɣ���Ҫ�ļ����Լ��У���������ˮ��ϡHNO3��NaOH��Һ�⣬����Ҫ___________��
(2)����ɰ��Ԫ�صIJⶨ��ȷ��ȡa g����ɰ��������������ͭ��ϼ���(�����ķ�ӦΪ��2NH4Cl+3CuO![]() 3Cu+N2��+2HCl��+3H2O)����������װ�òⶨ����ɰ�е�Ԫ������Ԫ�ص�����֮�ȡ�
3Cu+N2��+2HCl��+3H2O)����������װ�òⶨ����ɰ�е�Ԫ������Ԫ�ص�����֮�ȡ�
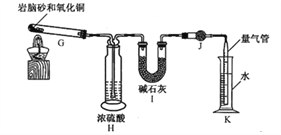
������װ��H��Ŀ����_____________��
����װ�â�����b g������װ��K����������ΪV L(��֪���³�ѹ������Ħ�����Ϊ24.5 L��mol-1)��������ɰ��m(N)��m(Cl)=_____________(�ú�b��V�Ĵ���ʽ��ʾ�����ػ���)��
���������ʱ�����¶ȸ��ڳ���(������������ȷ)����m(N)������ֵ_____________(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
���𰸡� 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O ����ʳ��ˮ a��dc hg��ji��b AgNO3��Һ����ɫʯ����ֽ ���ջ�������е�ˮ��������ֹ�Բⶨ�Ȼ������������Ӱ��
CaCl2+2NH3��+2H2O ����ʳ��ˮ a��dc hg��ji��b AgNO3��Һ����ɫʯ����ֽ ���ջ�������е�ˮ��������ֹ�Բⶨ�Ȼ������������Ӱ�� ![]() ��
��![]() ƫ��
ƫ��
���������������������������ɳ���Ʊ�Ϊ�زģ���Ҫ����NH3��Cl2��ȡԭ�����������ʵ��װ�����ӡ����ʵļ��顢������ռ���֪ʶ�����鿼��������ѧ֪ʶ��ʵ������ۺϷ�����������ʵ�����ݵĴ���������
��������1����Aװ�������ڹ�����ȷ��Ʊ����壬������ȡNH3ʱһ��ѡ��NH4Cl��Ca(OH)2����Ӧԭ����2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O����ʵ������Ũ������MnO2��Ӧ����������Bװ���н��������ɵ������к���ˮ�������Ȼ������壬������ѡ��F��ȥ�Ȼ������壬����E��ȥˮ����������F��ʢ�ű���ʳ��ˮ������ȡ��������������Ϊbijgh����ȡ��������������Ϊadc�����ǵ������ܶ�С�ڿ����������ܶȴ��ڿ�������������e��ͨ���a��dc��e����������f��ͨ���b��ij��gh��f������������Ȼ���е�笠�������ҪNaOH��Һ�ͺ�ɫʯ����ֽ�������м���Cl-������Ҫˮ��ϡ�����AgNO3��Һ��ȱ�ٵ�ʱAgNO3��Һ����ɫʯ����ֽ����ȷ����2NH4Cl+Ca(OH)2
CaCl2+2NH3��+2H2O����ʵ������Ũ������MnO2��Ӧ����������Bװ���н��������ɵ������к���ˮ�������Ȼ������壬������ѡ��F��ȥ�Ȼ������壬����E��ȥˮ����������F��ʢ�ű���ʳ��ˮ������ȡ��������������Ϊbijgh����ȡ��������������Ϊadc�����ǵ������ܶ�С�ڿ����������ܶȴ��ڿ�������������e��ͨ���a��dc��e����������f��ͨ���b��ij��gh��f������������Ȼ���е�笠�������ҪNaOH��Һ�ͺ�ɫʯ����ֽ�������м���Cl-������Ҫˮ��ϡ�����AgNO3��Һ��ȱ�ٵ�ʱAgNO3��Һ����ɫʯ����ֽ����ȷ����2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O������ʳ��ˮ��a��dc��hg��ji��b��AgNO3��Һ�ͺ�ɫʯ����ֽ����2��ʵ����G������������N2��HCl��H2O(g)������ͨ��Ũ������Գ�ȥH2O(g)����ͨ����ʯ��ʱֻ��HCl�μӷ�Ӧ�����գ����µ�N2�������������в�����������H��Ŀ��������ˮ��������ֹ��ʯ������ʱ��������װ�â����ص�6gΪHCl��
CaCl2+2NH3��+2H2O������ʳ��ˮ��a��dc��hg��ji��b��AgNO3��Һ�ͺ�ɫʯ����ֽ����2��ʵ����G������������N2��HCl��H2O(g)������ͨ��Ũ������Գ�ȥH2O(g)����ͨ����ʯ��ʱֻ��HCl�μӷ�Ӧ�����գ����µ�N2�������������в�����������H��Ŀ��������ˮ��������ֹ��ʯ������ʱ��������װ�â����ص�6gΪHCl��![]() ��K���N2��
��K���N2��![]() ������
������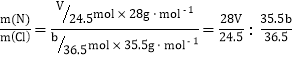 ���������ʱ�¶�ƫ�ߣ�ֱ�ӵ���Vƫ������m(N)ƫ�ߡ���ȷ�𰸣����ջ�������е�ˮ��������ֹ�Բⶨ�Ȼ������������Ӱ����
���������ʱ�¶�ƫ�ߣ�ֱ�ӵ���Vƫ������m(N)ƫ�ߡ���ȷ�𰸣����ջ�������е�ˮ��������ֹ�Բⶨ�Ȼ������������Ӱ����![]() ��
��![]() ��ƫ�ߡ�
��ƫ�ߡ�

����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
(1)��ͼ��N2(g)��H2(g)��Ӧ����1 mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��____________________________________________��

(2)��֪��ѧ���������γɻ��1 mol��ѧ���ų������յ���������λkJ��mol��1������֪�������ݣ�
��ѧ�� | HH |
|
����/kJ��mol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���________kJ��mol��1��
(3)��NH3����ԭNOx���������������������Ⱦ����֪��
4NH3(g)��3O2(g)===2N2(g)��6H2O(g) ��H1����a kJ��mol��1 ��
N2(g)��O2(g)===2NO(g) ��H2����b kJ��mol��1 ��
��1 mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�Ȧ�H3��________ kJ��mol��1(�ú�a��b��ʽ�ӱ�ʾ)��