��Ŀ����
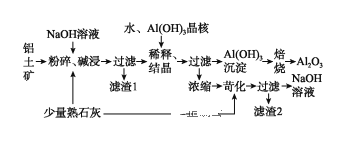
����Ŀ��ClO2��Cl2�������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ij��ȤС��ͨ��ͼ1װ�ã��г�װ���ԣ������Ʊ������ա��ͷź�Ӧ�ý������о�������֪��װ��C������������Cl2��
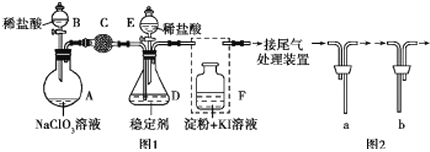
(1)����B��������________����װF�е���ʱ��Ӧѡ��ͼ2�е�_________________��
(2)��B�Ļ�����A�з�����Ӧ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��ΪʹClO2��D�б��ȶ���������գ��μ�ϡ������ٶ���_______________����������������������
(3)�ر�B�Ļ�����ClO2��D�б��ȶ�����ȫ��������NaClO2��NaClO2��Cl�Ļ��ϼ�Ϊ______��
(4)��֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2���÷�Ӧ�����ӷ���ʽΪ__________��
(5)��ҵ�Ͽ���KClO3��Na2SO3��H2SO4�������Ƶ�ClO2���÷�Ӧ���ӷ���ʽΪ___________________������֪��������������SO32����ClO3������ΪSO42����
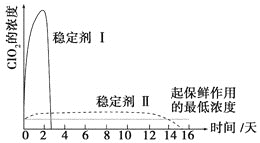
(6)������ClO2������ȶ��������ȶ�������������ͷ�ClO2��Ũ����ʱ��ı仯��ͼ3��ʾ������������ˮ�����ʣ�����ΪЧ���Ϻõ��ȶ�����__________��ԭ����________________��
���𰸡���Һ©�� b �� ��3 5ClO2����4H+��Cl����4ClO2��2H2O 2H+��2ClO3����SO32����SO42����2ClO2��H2O �ȶ����� ���ȶ��������������ܽϳ�ʱ�䱣��
��������
װ��A��ʢ��NaClO3��Һ��װ��Bʢ��ϡ���ᣬ���߷�����Ӧ��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O��װ��C������������Cl2����ȥ������ClO2��װ��D�б��ȶ�����ȫ��������NaClO2��������������NaClO2�ɷ�����Ӧ4H++5ClO2-=Cl-+4ClO2��+2H2O����NaCl���ͷų�ClO2��װ��F������������������Ƿ���ȫ��װ��C���գ�
(1) ���������ṹ������ȷ������B�����ƣ�Fװ��Ӧ��Cl2��KI��Ӧ������Ҫ����β������װ�ã�����Ӧ���ܽ������̹ܳ�����
(2) ΪʹClO2��D�б��ȶ���������գ�����ClO2������Ҫ����
(3) NaClO2��NaΪ+1�ۣ�OΪ-2�ۣ������������ϼ۴�����Ϊ0���ж�Cl�Ļ��ϼۣ�
(4) ������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2������Ԫ���غ��֪Ӧ����ˮ���ɣ�
(5) KClO3��H2SO4��������Na2SO3��Ӧ��SO32-��������SO42-���ɵ��ӡ�����غ�д��������Ӧ�����ӷ�Ӧ����ʽ��
(6) ��ͼ��֪���ȶ�������Ի����ͷ�ClO2���ܽϳ�ʱ��ά�ֱ��������Ũ�ȡ�
(1)����B�������������Ҵ��в���������Ϊ��Һ©����Fװ��Ӧ��Cl2��KI��Ӧ������Ҫ����β������װ�ã�����Ӧ���ܽ������̹ܳ�������ѡb��
(2) ΪʹClO2��D�б��ȶ���������գ�����ClO2������Ҫ�����ʵμ�ϡ������ٶ�Ҫ����
(3) NaClO2��NaΪ+1�ۣ�OΪ-2�ۣ������������ϼ۴�����Ϊ0����Cl�Ļ��ϼ�Ϊ+3��
(4) ������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2������Ԫ���غ��֪Ӧ����ˮ���ɣ��÷�Ӧ�����ӷ���ʽΪ��4H++5ClO2-=Cl-+4ClO2��+2H2O��
(5) KClO3��H2SO4��������Na2SO3��Ӧ�Ƶ�ClO2����֪SO32-��������SO42-���ɵ��ӡ�����غ��֪�����ӷ�ӦΪ2ClO3-+SO32-+2H+�T2ClO2+SO42-+H2O��
(6) ��ͼ��֪���ȶ�������Ի����ͷ�ClO2���ܽϳ�ʱ��ά�ֱ��������Ũ�ȣ������ȶ�����á�