题目内容
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
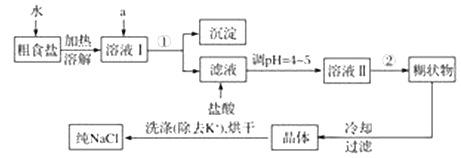
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在过滤过程中所需要的玻璃仪器有________________________________________。
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,选出a所代表的试剂,按滴加顺序依次为_______(只填化学式)。
(3)用于沉淀的试剂需过量,否则不能将杂质除尽,检验过滤的滤液中是否含有Fe3+的方法__________,过滤所得沉淀需要洗涤,洗涤沉淀的方法__________________。
(4)用提纯的NaCl配制成480ml 0.2molL-1的NaCl溶液,用托盘天平称取___________ g纯的NaCl晶体,用蒸馏水在_______________中溶解,完全溶解后,全部转移至________________中,加蒸馏水至______________________。
【答案】漏斗、烧杯、玻璃棒 NaOH、BaCl2、Na2CO3(或BaCl2、NaOH、Na2CO3) 取少量滤液加加入KSCN溶液,变红 沿玻璃棒向漏斗中加水,使水浸没沉淀,等水自然流下,重复2~3次 5.9 烧杯 500ml容量瓶 刻度线
【解析】
由实验流程可知,粗盐溶解后,溶液I中加a除去杂质,可以加入过量NaOH(除去镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(除去硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(除去钙离子及多余的钡离子):Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,操作①为过滤,分离出沉淀,滤液中加盐酸调节pH,发生H++OH-═H2O、CO32-+2H+═H2O+CO2↑,得到溶液II含KCl、NaCl,操作为蒸发,得到糊状物再冷却、过滤分离出晶体,然后75%乙醇洗涤、烘干得到NaCl,以此来解答。
(1)在过滤过程中所需要的玻璃仪器有玻璃棒、漏斗、烧杯;
(2) 除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH发生Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2发生SO42-+Ba2+=BaSO4↓;加入过量Na2CO3发生Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,则试剂顺序为BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
(3) 含有Fe3+的溶液中滴加KSCN溶液显红色,则检验过滤的滤液中是否含有Fe3+的方法是取少量滤液加加入KSCN溶液,变红,说明仍含有Fe3+;过滤所得沉淀需要洗涤,洗涤沉淀的操作方法是沿玻璃棒向漏斗中加水,使水浸没沉淀,等水自然流下,重复2~3次;
(4)因实验室没有480mL容量瓶,需要选择500mL容量瓶,则0.2molL-1的NaCl溶液500mL需要的NaCl质量为0.2molL-1×0.5L×58.5g/mol=5.85g,因天平只能精确到0.1g,故用托盘天平称取5.9g纯的NaCl晶体,用蒸馏水在烧杯中溶解,完全溶解后,全部转移至500mL容量瓶中,加蒸馏水至刻度线与凹液面相切为止。

【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移