题目内容
【题目】明矾可用于制取钾肥和冶炼铝,具体工艺流程如下图所示:
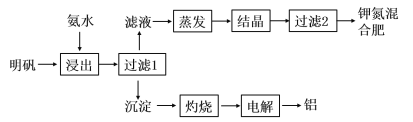
(1)“浸出”反应的离子方程式为__________________________________。“浸出”所用稀氨水浓度为6mol/L,则配制100mL该氨水需12mol/L的浓氨水的体积为______mL,若量取该浓氨水时俯视刻度线,会导致配制的稀氨水浓度________(填“偏高”、“偏低”或“无影响”)。
(2)检验“过滤1”所得沉淀是否洗净的实验方法是_______________________________。
(3)请写出“电解”熔融氧化铝制取金属铝的化学方程式________________________。
【答案】Al3++3NH3H2O = Al(OH)3 ↓+3NH4+ 50 偏低 取最后一次洗涤液于试管中,加入足量稀盐酸,再加BaCl2溶液,若无白色沉淀产生,则证明已洗净 2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
【解析】
明矾为十二水和硫酸铝钾,用氨水浸出时,铝离子与氨水反应生成氢氧化铝和铵根离子,则沉淀为氢氧化铝,灼烧生成氧化铝,电解生成铝单质和氧气;滤液为硫酸钾、硫酸铵的混合液,蒸发结晶,过滤可得钾氮混合肥。
(1)铝离子与氨水反应生成氢氧化铝和铵根离子,离子方程式为Al3++3NH3H2O = Al(OH)3 ↓+3NH4+;溶液的稀释时,溶质的物质的量不变,则6×100=12×V,V=50mL;量取该浓氨水时俯视刻度线,导致量取浓氨水的体积减小,则物质的量减小,配制溶液的浓度偏低;
(2)若沉淀未洗净时,沉淀表面会含有硫酸根离子,可用氯化钡检验其存在,检验方法为取最后一次洗涤液于试管中,加入足量稀盐酸,再加BaCl2溶液,若无白色沉淀产生,则证明已洗净;
(3)电解熔融状态的氧化铝时,生成铝和氧气,方程式为2Al2O3 ![]() 4Al+3O2↑。
4Al+3O2↑。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案