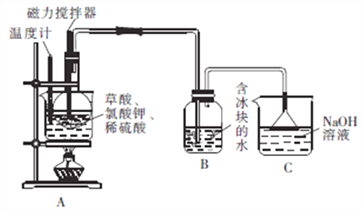
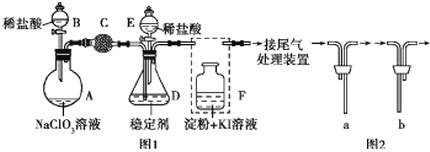
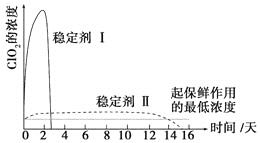
题目内容
【题目】某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:
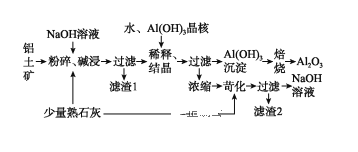
请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________。滤渣1的主要成分为________________。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________。
(6)该生产流程能实现____________________(填化学式)的循环利用。
【答案】加快反应速率 Fe2O3 Al2O3+2OH-=2AlO2-+H2O CO2 2Al(OH)3![]() Al2O3+3H2O Ca(OH)2 +Na2CO3=CaCO3↓+2NaOH NaOH
Al2O3+3H2O Ca(OH)2 +Na2CO3=CaCO3↓+2NaOH NaOH
【解析】
铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝。
(1)温度升高会加快反应速率;铝土矿中的Fe2O3不溶于NaOH溶液,Al(OH)3和Al2O3都和强碱溶液反应生成Al2O3;
(2)Al2O3与NaOH溶液反应生成NaAlO2和水;
(3)NaHCO3可用来做发酵粉,在偏铝酸钠溶液中通入过量二氧化碳气体可生成Al(OH)3和NaHCO3;
(4)焙烧过程中为Al(OH)3受热分解生成Al2O3和水;
(5) 浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子;
(6) 后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿。
铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝;
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是加快反应速率;铝土矿中的Fe2O3不溶于NaOH溶液,Al(OH)3和Al2O3都和强碱溶液反应生成Al2O3,则滤渣1的主要成分为Fe2O3;
(2) Al2O3与NaOH溶液反应生成NaAlO2和水,则发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
(3) NaHCO3可用来做发酵粉,在偏铝酸钠溶液中通入过量二氧化碳气体可生成Al(OH)3和NaHCO3,则上述“稀释、结晶”工艺,也可用通入足量的CO2气体的方法来代替;
(4) 焙烧过程中为Al(OH)3受热分解生成Al2O3和水,发生的化学方程式为2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(5) 浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子,方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(6) 后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿,该生产流程能实现的循环利用是NaOH。

【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D