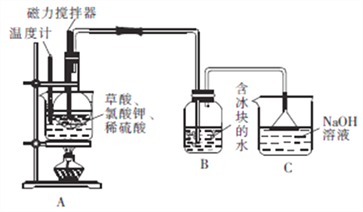
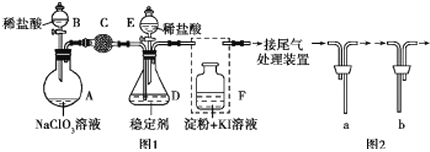
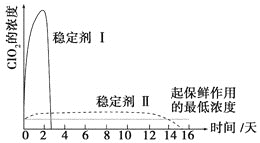
题目内容
【题目】粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是:____________,产物中单质B是________。
(2)②中所发生的各反应的化学方程式为____________________、________________。
(3)③中所发生的各反应的离子方程式为___________________、_____________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
【答案】在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃 Fe Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ 0.67 mol·L-1 2.3 mol·L-1
【解析】
①MgO不能与铝发生置换反应,所以发生的反应是Fe2O3+2Al![]() 2Fe+Al2O3;②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,则③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,溶液D为MgCl2、FeCl2的混合溶液。
2Fe+Al2O3;②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,则③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,溶液D为MgCl2、FeCl2的混合溶液。
(1)①中引发铝热反应的实验操作是:在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃,产物中单质B是Fe;
答案:在A和铝粉的混合物表面加少量KClO3,插上镁带并将其点燃 Fe
(2)根据上面分析可知②中所发生的各反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O;
答案:Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O
(3) 上面分析可知③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑,反应的离子方程式为Fe+2H+=Fe2++H2↑ ,Fe+2Fe3+=3Fe2+;
答案:Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+
(4)根据题意,假设20 g A中MgO和Fe2O3的物质的量均为x mol,则x mol×40 g·mol-1+x mol×160 g·mol-1=20 g,解得x=0.1。溶液D中Mg2+的物质的量等于MgO的物质的量,即n(Mg2+)=0.1mol,故c(Mg2+)=0.1mol÷0.15L≈0.67mol·L-1;步骤③中反应发生后原先加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,根据Cl-守恒和电荷守恒可知,溶液D中:n(Cl-)=n(Mg2+)×2+n(Fe2+)×2=6.0 mol·L-1×0.15 L=0.9 mol,n(Fe2+)=0.35 mol,故c(Fe2+)=0.35mol÷0.15L≈2.3 mol·L-1。
答案:0.67 mol·L-1 2.3 mol·L-1

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移