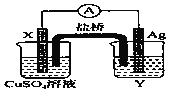
题目内容
【题目】A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5。
(1)C的原子结构示意图为______,D在元素周期表中的位置______。
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为________;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程__________________。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为________________。
(4)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增,______________________________,非金属性增强。
(5)工业上将干燥的E单质通入D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为__________________。
【答案】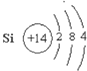 第3周期,第VIA族离子键、非极性共价键
第3周期,第VIA族离子键、非极性共价键![]() Fe2O3+2Al
Fe2O3+2Al![]() 2Fe+Al2O3原子半径递减,得电子能力增强2S2Cl2﹢2H2O=3S+SO2↑+4HCl
2Fe+Al2O3原子半径递减,得电子能力增强2S2Cl2﹢2H2O=3S+SO2↑+4HCl
【解析】
A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,所以E为氯元素,据此解答。
根据以上分析可知A是Na,B是Al,C是Si,D是S,E是Cl。则
(1)C为硅元素,C的原子结构示意图为![]() ,D为硫元素,D在元素周期表中的位置是第三周期第VIA族。
,D为硫元素,D在元素周期表中的位置是第三周期第VIA族。
(2)钠单质在氧气中燃烧生成化合物甲为过氧化钠,甲中所含化学键为离子键、非极性共价键;钠单质在氯气中燃烧生成化合物乙为氯化钠,氯化钠属于离子化合物,其形成过程为![]() 。
。
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素,因此该反应的化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(4)氯元素的非金属性强于硫元素,这是由于同周期元素随着原子序数的递增,原子半径递减,得电子能力增强,非金属性增强。
(5)工业上将干燥的E单质通入D熔融的单质中可制得化合物为S2Cl2,该物质可与水反应生成一种能使品红溶液褪色的气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,则1molS2Cl2参加反应要转移1.5mol电子,其中只有一种元素化合价发生改变,则应为硫元素的化合价在改变,因此该反应的化学方程式为2S2Cl2+2H2O=3S+SO2↑+4HCl。