题目内容
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸): Cu(NH3)2Ac+CO+NH3==Cu(NH3)3 (CO) Ac。
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为________。
(2)配合物Cu(NH3)3 (CO) Ac中心原子的配位数为________,基态铜原子核外电子排布式为_________________。
(3)写出与CO互为等电子体的粒子________ (任写一个) 。
(4)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中,C原子轨道的杂化类型为________;1 mol尿素分子中,σ键的个数为____________。(设NA为阿伏加德罗常数的值)
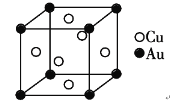
(5)铜金合金形成的晶胞如图所示,其中Cu、Au原子个数比为________。铜单质晶胞与铜金合金的晶胞相似,晶胞边长为3.61×10-8cm,则铜的密度为________g/cm-3(结果保留3位有效数字)。
【答案】N>O>C41s2 2s2 2p6 3s2 3p6 3d10 4s1CN-、N2等(其他合理答案)sp2杂化7NA3∶19.04
【解析】
(1)一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;(2)根据化合物的化学式判断,一价铜离子有三个氨基配体和一个羰基配体,共4个配体;铜原子的核外电子排布为1s22s22p63s23p63d104s1,一价铜离子为失去一个电子,核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;(4)计算杂化类型时根据电子对数来判断,中心原子的价电子数与配体电子数的和除以2就得到电子对数,根据电子对数,可以确定杂化类型;(5)计算晶胞中原子个数时,首先数一下原子个数,然后看其被几个晶胞共用,乘以相应的倒数即可;晶胞中微粒个数的计算用均摊法。
(1)一般来说非金属性越强,第一电离能大,所以O>N>C.但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以O比N容易失去电子,故答案为:N>C>O;(2)一价铜离子有三个氨基配体和一个羰基配体,共4个配体,故答案为:4;铜原子的核外电子排布为1s22s22p63s23p63d104s1;故一价铜离子的核外电子排布为1s22s22p63s23p63d10或[Ar]3d10;(3)价电子数与原子数都分别相等的粒子是等电子体,因此与CO互为等电子体的一种分子和一种离子的化学式分别是N2或CN-等;(4)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2;σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA;(5)每个晶胞中铜位于面心,每个铜原子,被两个晶胞共用,每个晶胞中铜原子的个数为6×0.5=3,金原子位于角上,每个金原子被8个晶胞共用,故每个晶胞中金原子个数为8×0.125=1,故铜金原子个数比为3:1;铜单质晶胞与铜金合金的晶胞相似,晶胞边长为3.61×10-8cm,则铜的密度为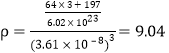 g/cm-3。
g/cm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案