题目内容
14.已知H2S,Ka1=1.3×10-7,Ka2=7.1×10-15,若只考虑S-2第一步水解,则浓度为0.1mol/L的Na2S溶液中的PH值为13-lg1.5.分析 Na2S的水解平衡常数Kh=$\frac{c(H{S}^{-})×c(O{H}^{-})}{c({S}^{2-})}$=$\frac{{K}_{w}}{K{a}_{2}}$=$\frac{1{0}^{-14}}{7.1×1{0}^{-15}}$=0.14,设Na2S溶液中氢氧根离子的浓度为xmol/L,根据水解常数计算.
解答 解:Na2S的水解平衡常数Kh=$\frac{c(H{S}^{-})×c(O{H}^{-})}{c({S}^{2-})}$=$\frac{{K}_{w}}{K{a}_{2}}$=$\frac{1{0}^{-14}}{7.1×1{0}^{-15}}$=0.14,
设Na2S溶液中氢氧根离子的浓度为xmol/L,
则$\frac{{x}^{2}}{0.1-x}$=0.14,解得x=0.0675,
则c(H+)=$\frac{1{0}^{-14}}{0.0675}$=1.5×10-13mol/L,所以pH=13-lg1.5;
故答案为:13-lg1.5.
点评 本题考查了电离常数和水解常数以及pH的计算,题目难度中等,侧重于考查学生的计算能力和分析能力,注意把握电离常数与水解常数的关系.

练习册系列答案
相关题目
7.下列物质的性质,属于化学性质的是( )
| A. | 活性炭的吸附性 | B. | 石墨的导电性 | C. | 碳酸的不稳定性 | D. | 汽油的挥发性 |
2.将4.4g二氧化碳通入含5.6g氢氧化钠的溶液中,则反应后溶液中的溶质( )
| A. | 只有Na2CO3 | B. | 只有NaHCO3 | ||
| C. | 有Na2CO3也有NaHCO3 | D. | 没有Na2CO3也没有NaHCO3 |
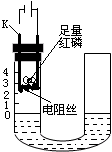 研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请根据图示实验回答下列问题:
研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请根据图示实验回答下列问题: 2 ?+3 H2↑ D.Al3++4 OH?→AlO2? +2H2O
2 ?+3 H2↑ D.Al3++4 OH?→AlO2? +2H2O