题目内容
已知NaOH+Al(OH)3→NaAlO2。向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是( )
A.CO2+2OH?→CO32?+H2O B.Al2O3+2OH?→2 AlO2 ? +H2O
C.2 Al+2OH?+2H2O→2 AlO 2 ?+3 H2↑ D.Al3++4 OH?→AlO2? +2H2O
2 ?+3 H2↑ D.Al3++4 OH?→AlO2? +2H2O
练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
16.可以一次性将空气、氧气、氢气、二氧化碳区别开的最好方法是( )
| A. | 分别加入适量澄清石灰水 | B. | 分别滴加紫色石蕊试液 | ||
| C. | 分别将带火星的木条伸入瓶中 | D. | 分别将燃着的木条伸入瓶中 |


 氧气扩散至电极表面
氧气扩散至电极表面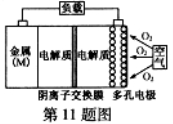 B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
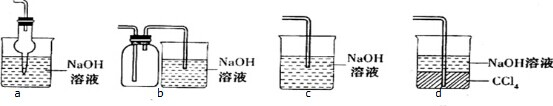
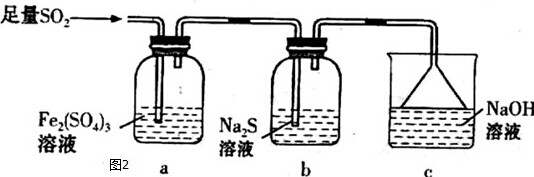
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题: