题目内容
9.元素及其化合物在日常生活中应用广泛,回答下列问题.(1)CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(2)某硫酸厂在进行黄铁矿成分(主要成分FeS2)测定时,取0.10g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL,已知SO2+2Fe3++2H2O═SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,则样品中FeS2的质量分数是90.00%.(假设杂质不参加反应)
(3)王水是浓硝酸与浓盐酸的混合溶液,可以溶解金、铂等金属,金溶于王水时产生H[AuCl4]和一种无色气体,该气体遇空气变为红棕色,写出该反应的化学方程式Au+NO3-+4H++4Cl-=[AuCl4]-+NO↑+2H2O.
分析 (1)铜离子变成了亚铜离子,被还原,亚硫酸根被氧化成硫酸根,写成反应,根据化合价升降相等配平方程式;
(2)根据原子守恒及电子转移列出关系式,根据关系式计算样品中FeS2的质量分数;
(3)根据题中信息,铂溶于王水时产生H[AuCl4]和一种无色气体为一氧化氮,据此写出反应的离子方程式.
解答 解:(1)在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热生成了CuCl,亚硫酸根检验还原性,被氧化成硫酸根,根据化合价变化配平方程式可得:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(2)令样品中FeS2的质量分数是x,则:
3FeS2~6SO2~12Fe2+~2Cr2O72-
3×120g 2mol
0.1xg 0.025L×0.02mol/L
所以$\frac{3×120g}{0.1xg}$=$\frac{2mol}{0.025L×0.02mol/L}$,解得,x=90.00%,故答案为:90.00%.
(3)根据题中信息,铂溶于王水时产生[AuCl4]-和一种无色气体为一氧化氮,反应的离子方程式为:Au+NO3-+4H++4Cl-=[AuCl4]-+NO↑+2H2O,故答案为:Au+NO3-+4H++4Cl-=[AuCl4]-+NO↑+2H2O.
点评 考查根据方程式进行的多步计算、方程式的书写等知识,难度较大,注意根据关系式进行计算时清楚反应过程寻找关系式是关键.

 快捷英语周周练系列答案
快捷英语周周练系列答案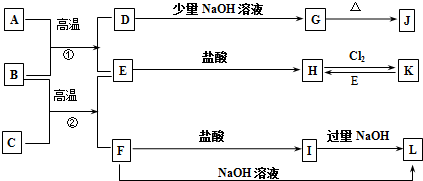
 .
.





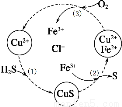
 氧气扩散至电极表面
氧气扩散至电极表面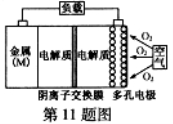 B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高