题目内容
6.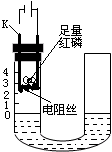 研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请根据图示实验回答下列问题:
研究性学习小组的同学为探究空气中氧气的体积分数,设计了如图所示装置.请根据图示实验回答下列问题:(1)闭合电源开关,可以观察到红磷燃烧,产生大量的白烟;反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(2)装置冷却到室温时,可观察到U型管内左侧液面上升至大约1处.
(3)此实验还可推知反应后剩余气体的两点性质是:不与红磷反应,不溶于水.
分析 本题中空气中氧气的含量,是用红磷测定的,保证该实验成功的关键是:①装置的气密性要好;②红磷要足量;③必须冷却到室温再读数;④左右液面存在高度差等.做本实验时,要注意把空气中的氧气充分消耗掉,而又不能加入新的气体.
解答 解:(1)闭合电源开关,可观察到红磷燃烧,产生大量的白烟,反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;故答案为:燃烧,产生大量的白烟;4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)装置冷却到室温时,可观察到U型管内左侧液面上升,约上升至1处;故答案为:上升至大约1处;
(3)此实验可推知反应后剩余气体的两点性质是:不与红磷反应,不溶于水,故答案为:不与红磷反应;不溶于水.
点评 本题主要考查用红磷测定空气组成的实验原理、操作、现象、结论和注意事项,难度稍大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
18.在空气中铝制品比铁制品更不易被锈蚀,原因是( )
| A. | 铝的金属活动性比铁弱 | |
| B. | 铝的密度比铁的密度小 | |
| C. | 铝在空气中易与氧气形成一层致密的氧化膜 | |
| D. | 铝不能与氧气发生反应 |
19.下列实验现象描述不正确的是( )
| A. | 铁丝在氧气中燃烧生成黑色固体物质 | |
| B. | 给水通直流电一段时间,正极和负极的气体体积比为2:1 | |
| C. | 二氧化碳通入紫色石蕊试液,紫色石蕊试液变成红色 | |
| D. | 红磷在空气中燃烧,产生大量白烟 |
16.可以一次性将空气、氧气、氢气、二氧化碳区别开的最好方法是( )
| A. | 分别加入适量澄清石灰水 | B. | 分别滴加紫色石蕊试液 | ||
| C. | 分别将带火星的木条伸入瓶中 | D. | 分别将燃着的木条伸入瓶中 |