题目内容
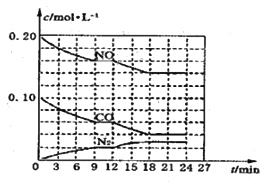
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
【答案】D
【解析】A. 在含H2A、HA-和A2-的溶液中,当α(HA-)较大时,加入少量NaOH固体,因HA-与OH-反应生成A2-和H2O,会使α(HA-)减小,故A错误;B. 由图可知,将等物质的量的NaHA和Na2A混合物溶于水,所得溶液的pH小于7,则HA-的电离程度大于HA-和A2-的水解程度,所以α(HA-)<α(A2-),故B错误;C. 由图可知,当HA-浓度远大于其它溶质时,溶液的pH小于7,呈酸性,说明HA-电离出的氢离子浓度远大于其水解出的氢氧根离子浓度,所以HA-的水解能力小于其电离能力,故C错误;D. 在只含H2A、HA-和A2-的溶液中,根据电荷守恒有:c(HA-)+2c(A2-)+c(OH-)=c(H+),若c(H2A)+2c(A2-)+c(OH-)=c(H+),则c(H2A)和c(HA-)相等,α(H2A)与α(HA-)也相等,但是溶液中可能还有其他阳离子,所以α(H2A)与α(HA-)不一定相等,故D正确;答案选D。

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目