题目内容
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
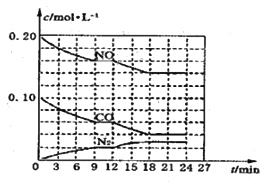
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
【答案】 -746.5 4.4×10-3 D 22.2% 3.4 1.0×10-7
【解析】试题分析:本题考查盖斯定律的应用,图像的分析,化学反应速率和化学平衡的计算,外界条件对化学反应速率和化学平衡的影响,电离平衡常数的计算。
(1)①N2(g)+O2(g)=2NO(g) ΔH=180.5kJ/mol
根据C和CO的燃烧热可写出热化学方程式
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ/mol
O2(g)=CO2(g) ΔH=-283kJ/mol
应用盖斯定律,③![]() 2-①得,2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=2
2-①得,2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=2![]() (-283kJ/mol)-(180.5kJ/mol)=-746.5kJ/mol。
(-283kJ/mol)-(180.5kJ/mol)=-746.5kJ/mol。
(2)①由图像可知0~9min内的平均反应速率υ(CO)=![]() =
=![]() =4.4
=4.4![]() 10-3mol/(L·min)。根据图像9min时反应达到平衡状态,9~12min保持平衡状态,12min时改变条件,18min达到新平衡,此过程中υ(CO)=
10-3mol/(L·min)。根据图像9min时反应达到平衡状态,9~12min保持平衡状态,12min时改变条件,18min达到新平衡,此过程中υ(CO)=![]() =
=![]() =3.3
=3.3![]() 10-3mol/(L·min),12min~18min内NO、CO浓度减小,N2浓度增大,12min时改变条件化学反应速率减慢,平衡向正反应方向移动。A,升高温度,化学反应速率加快,平衡向逆反应方向移动,A项不可能;B,加入NO,NO的浓度应突然增大,化学反应速率加快,平衡向正反应方向移动,B项不可能;C,加入催化剂,化学反应速率加快,平衡不移动,C项不可能;D,降低温度,化学反应速率减慢,平衡向正反应方向移动,D项可能;答案选D。
10-3mol/(L·min),12min~18min内NO、CO浓度减小,N2浓度增大,12min时改变条件化学反应速率减慢,平衡向正反应方向移动。A,升高温度,化学反应速率加快,平衡向逆反应方向移动,A项不可能;B,加入NO,NO的浓度应突然增大,化学反应速率加快,平衡向正反应方向移动,B项不可能;C,加入催化剂,化学反应速率加快,平衡不移动,C项不可能;D,降低温度,化学反应速率减慢,平衡向正反应方向移动,D项可能;答案选D。
②根据图像写出到18min时的三段式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L) 0.2 0.1 0 0
c(转化)(mol/L)0.06 0.06 0.03 0.06
c(平衡)(mol/L)0.14 0.04 0.03 0.06
此时CO2的体积分数为![]() 100%=22.2%。化学平衡常数K=
100%=22.2%。化学平衡常数K=![]() =
=![]() =3.4。
=3.4。
(3)0.1mol/LHCOONa溶液的pH=10,溶液中c(H+)=1![]() 10-10mol/L,溶液中c(OH-)=1
10-10mol/L,溶液中c(OH-)=1![]() 10-4mol/L,根据水解平衡方程式HCOO-+H2O
10-4mol/L,根据水解平衡方程式HCOO-+H2O![]() HCOOH+OH-,溶液中c(HCOOH)=1
HCOOH+OH-,溶液中c(HCOOH)=1![]() 10-4mol/L,c(HCOO-)=0.1mol/L-1
10-4mol/L,c(HCOO-)=0.1mol/L-1![]() 10-4mol/L
10-4mol/L![]() 0.1mol/L,HCOOH的电离常数Ka=
0.1mol/L,HCOOH的电离常数Ka=![]() =
=![]() =1
=1![]() 10-7。
10-7。

 名校课堂系列答案
名校课堂系列答案【题目】下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A |
| 稀硫酸 |
|
B |
| 氢氧化钠溶液 |
|
C |
| 氢氧化钠溶液 |
|
D |
| 过量氢氧化钠溶液 |
|
A. A B. B C. C D. D

