题目内容
【题目】甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) ![]() CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
(1)某研究小组,在温度和容器的容积保持不变时,研究该反应是否达到平衡状态,以下五位同学对平衡状态的描述正确的是__________。
A.甲:H2的消耗速率等于CH3OH的生成速率
B.乙:容器内的压强保持不变
C.丙:容器内气体的密度保持不变
D.丁:容器中气体的平均摩尔质量保持不变
(2)若在一定温度下、容积为2L的密闭容器中,投入2 mol CO、4 mol H2,保持恒温、恒容,测得反应达到平衡时H2转化率为75%,求平衡时CH3OH的浓度=__________mol/L
(3)已知在298K、101kPa下:甲醇的燃烧热化学方程式为:
CH3OH(l)+ 3/2 O2(g)= CO2(g)+ 2H2O(l) ΔH= -725.8 kJ·mol-1;
CO的燃烧热化学方程式为:CO(g)+ 1/2 O2(g)= CO2(g) ΔH= -283 kJ·mol-1;
H2O (g) === H2O(l) ΔH= -44 kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式__________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)
①该电池中通入甲醇的是电源的__________(填正、负)极,若KOH溶液足量,则写出电池总反应的离子方程式__________。
②若电解质溶液中KOH的物质的量为0.5mol,当有0.5mol甲醇参与反应时,产物恰好为KHCO3时,该电池的负极反应式为__________,所得溶液中各种离子的物质的量浓度由大到小的顺序是__________。
【答案】 BD 0.75 mol/L CH3OH (l)+O2(g) = CO (g)+ H2O(g) ΔH= -354.8 kJ·mol-1 负 2CH3OH+3O2+4OH- = 2CO32-+6H2O CH3OH – 6e- + 7OH- = HCO3- + 5H2O c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)A. H2的消耗速率不会等于CH3OH的生成速率,A错误;B. 若压强保持不变,则气体体积既不增加也不减少,方程处于平衡状态,B正确;C. 由于方程不论向那个方向进行,总质量不变,容器体积固定,则气体密度不发生改变,C错误;D. 方程式两端物质平均摩尔质量不同,若平均摩尔质量不变,则方程平衡,D正确。故选择BD。
(2)消耗75%的氢气,即消耗3mol氢气,生成甲醇1.5mol,则容器内甲醇的浓度为0.75 mol/L;
(3)反应方程为CH3OH (l)+O2(g) = CO (g)+ H2O(g),ΔH= [-725.8-(-283)-(-44)×2] kJ·mol-1 =-354.8 kJ·mol-1
(4)①因为氧气要在正极得到电子,所以甲醇在负极失去电子被氧化;离子方程式为:2CH3OH+3O2+4OH- = 2CO32-+6H2O;
②负极CH3OH失去电子,与KOH反应生成KHCO3,离子方程式为:CH3OH – 6e- + 7OH- = HCO3- + 5H2O;反应生成KHCO3,同时存在H2O+HCO3-===(可逆)CO32++2OH-,故溶液中的离子为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。

【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
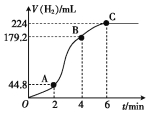
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。