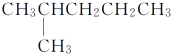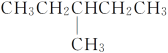题目内容
【题目】根据如图所示实验装置,回答下列问题:
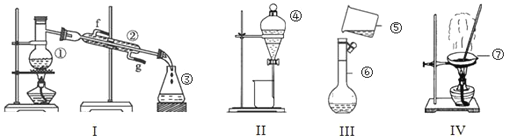
(1)写出下列仪器的名称:②_________,③_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的是______________(填仪器名称)。
(3)实验室准备用18mol/L浓硫酸配制100mL 3mol/L稀硫酸,则所需浓硫酸的体积是____mL(保留一位小数),量取浓硫酸所用量筒的规格是____(选填“10mL”、“25mL”或“50mL”)。在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是_______,若所配制的稀硫酸浓度偏大,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,俯视溶液的凹液面
【答案】冷凝管 锥形瓶蒸发皿分液漏斗、容量瓶16.7mL25mL重新配制BCD
【解析】
(1)根据仪器构造可知②是冷凝管,③是锥形瓶,⑦是蒸发皿;
(2)分液漏斗、容量瓶在使用之前需检查装置是否会漏水;
(3)根据稀释过程中溶质的物质的量不变可知用18mol/L浓硫酸配制100mL 3mol/L稀硫酸所需浓硫酸的体积是![]() ,因此量取浓硫酸所用量筒的规格是25mL;在实验操作的摇匀过程中,不慎洒出几滴,溶质减少,则此时应采取的措施是重新配制;A.配制前,容量瓶中有少量蒸馏水不影响,A错误;B.量取浓硫酸时,仰视液体的凹液面,浓硫酸的体积增加,浓度偏高,B正确;C.未冷却,立即转移至容量瓶定容,冷却后溶液体积减少,浓度偏高,C正确;D.定容时,俯视溶液的凹液面,溶液体积减少,浓度偏高,D正确。答案选BCD。
,因此量取浓硫酸所用量筒的规格是25mL;在实验操作的摇匀过程中,不慎洒出几滴,溶质减少,则此时应采取的措施是重新配制;A.配制前,容量瓶中有少量蒸馏水不影响,A错误;B.量取浓硫酸时,仰视液体的凹液面,浓硫酸的体积增加,浓度偏高,B正确;C.未冷却,立即转移至容量瓶定容,冷却后溶液体积减少,浓度偏高,C正确;D.定容时,俯视溶液的凹液面,溶液体积减少,浓度偏高,D正确。答案选BCD。

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
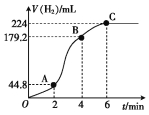
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。