题目内容
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
,则N2的转化率α= ;若此时放出热量为a KJ,则其热化学方程式为 .
②氨气溶于水则为氨水.已知NH3?H2O的电离平衡常数为Kb,计算0.1mol/L的NH3?H2O溶液中c(OH-)= mol/L(设平衡时NH3?H2O的浓度约为0.1mol/L,用含有Kb的代数式表示).
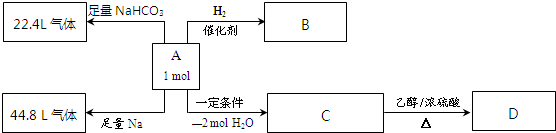
③合成氨的原料气H2可来自CH4的综合利用:CH4+H2O═CO+3H2.将CH4设计成燃料电池,其利用率更高,装置示意如图一(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.44.8L<V≤89.6L时,负极电极反应为 .
(2)以氨气、空气为主要原料先进行氨的催化氧化,然后制得硝酸.
①其中NO在容积恒定的密闭容器中进行反应:2NO(g)+O2(g)?2NO2(g)△H>0
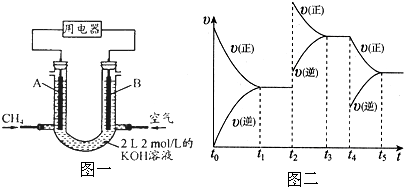
该反应的反应速率(v)随时间(t)变化的关系如图二所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) .
a.在t1~t2时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时与在t1~t2时的平衡常数K肯定相同
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
②实际上,生成的NO2会聚合生成N2O4.如果在一密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是 .
③硝酸厂常用如下方法处理尾气用Na2CO3溶液吸收NO2生成CO2.若每9.2g NO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 .
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0
①一定温度下,在密闭容器中充入1mol N2和3mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
| 15 |
| 16 |
②氨气溶于水则为氨水.已知NH3?H2O的电离平衡常数为Kb,计算0.1mol/L的NH3?H2O溶液中c(OH-)=
③合成氨的原料气H2可来自CH4的综合利用:CH4+H2O═CO+3H2.将CH4设计成燃料电池,其利用率更高,装置示意如图一(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.44.8L<V≤89.6L时,负极电极反应为

(2)以氨气、空气为主要原料先进行氨的催化氧化,然后制得硝酸.
①其中NO在容积恒定的密闭容器中进行反应:2NO(g)+O2(g)?2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图二所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
a.在t1~t2时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时与在t1~t2时的平衡常数K肯定相同
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
②实际上,生成的NO2会聚合生成N2O4.如果在一密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是
③硝酸厂常用如下方法处理尾气用Na2CO3溶液吸收NO2生成CO2.若每9.2g NO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
考点:反应热和焓变,原电池和电解池的工作原理,化学平衡建立的过程,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)①依据化学平衡三段式列式计算得到;求出反应的△H,写出热化学方程式;
②c(NH4+)=c(OH-),据Kb表达式和平衡时NH3?H2O的浓度可以求得;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应;
(2)①2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、反应中气体质量守恒,体积不变,过程中密度不变;
b、反应是吸热反应升温正逆反应速率增大,平衡正向进行;
c、K受温度影响;
d、依据图象分析容器内NO2的体积分数在t3~t4时最大;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K值,K减小,说明升高了温度,平衡逆向移动;
③根据n=
计算NO2的物质的量,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,根据注意电子数计算生成NO3-的物质的量,再根据电子转移守恒计算N元素在还原产物中的化合价,判断还原产物,据此书写.
②c(NH4+)=c(OH-),据Kb表达式和平衡时NH3?H2O的浓度可以求得;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应;
(2)①2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、反应中气体质量守恒,体积不变,过程中密度不变;
b、反应是吸热反应升温正逆反应速率增大,平衡正向进行;
c、K受温度影响;
d、依据图象分析容器内NO2的体积分数在t3~t4时最大;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K值,K减小,说明升高了温度,平衡逆向移动;
③根据n=
| m |
| M |
解答:
解:①压强之比等于物质的量之比,达到平衡状态时,容器内的压强是原来的
,则减少的物质的量为(1+3)mol×(1-
)=
mol,则:
N2(g)+3H2(g)?2NH3(g) 物质的量减少△n
1 2
n(N2)
故n(N2)=
mol,所以氮气的转化率=
×100%=12.5%;
mol氮气反应放热aKJ,则1mol氮气反应放热8aKJ,所以热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-8aKJ/mol,
故答案为:12.5%;N2(g)+3H2(g)?2NH3(g)△H=-8aKJ/mol;
②据NH3?H2O的电离方程式可知,c(NH4+)=c(OH-),已知NH3?H2O的浓度约为0.1mol/L,Kb=
=
,可得:c(OH-)=
,故答案为:
;
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
(2)①2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、反应中气体质量守恒,体积不变,过程中密度不变,所以,密度不变不能说明反应达到平衡状态,故a错误;
b、反应是吸热反应,升温正逆反应速率都增大,平衡正向进行,故b正确;
c、t2时升高了温度,K增大,所以在t3~t4时与在t1~t2时的平衡常数K不同,故c错误;
d、t2时升高了温度,平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,所以,容器内NO2的体积分数在t3~t4时最大,故d错误;
故选:b;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K=4.375,K减小,说明升高了温度,平衡逆向移动,故答案为:升高温度.
③9.2gNO2的物质的量=
=0.2mol,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为
=0.1mol,故被还原的氮原子物质的量为0.2mol-0.1mol=0.1mol,令N元素在还原产物中的化合价为x价,则0.1mol×(4-x)=0.1mol,解得x=+3,故还原产物为NO2-,且生成的NO3-和NO2-物质的量之比为1:1,同时反应生成CO2,故二氧化氮和碳酸钠溶液反应的离子反应方程式为:2NO2+CO32-=NO3-+NO2-+CO2,故答案为:2NO2+CO32-=NO3-+NO2-+CO2.
| 15 |
| 16 |
| 15 |
| 16 |
| 1 |
| 4 |
N2(g)+3H2(g)?2NH3(g) 物质的量减少△n
1 2
n(N2)
| 1 |
| 4 |
故n(N2)=
| 1 |
| 8 |
| ||
| 1 |
| 1 |
| 8 |
故答案为:12.5%;N2(g)+3H2(g)?2NH3(g)△H=-8aKJ/mol;
②据NH3?H2O的电离方程式可知,c(NH4+)=c(OH-),已知NH3?H2O的浓度约为0.1mol/L,Kb=
| c(NH4+)?c(OH-), |
| c(NH3?H2O) |
| [c(OH-)]2 |
| 0.1 |
| 0.1Kb |
| 0.1Kb |
③n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
(2)①2NO(g)+O2(g)?2NO2(g))△H>0.反应是气体体积减小的吸热反应;
a、反应中气体质量守恒,体积不变,过程中密度不变,所以,密度不变不能说明反应达到平衡状态,故a错误;
b、反应是吸热反应,升温正逆反应速率都增大,平衡正向进行,故b正确;
c、t2时升高了温度,K增大,所以在t3~t4时与在t1~t2时的平衡常数K不同,故c错误;
d、t2时升高了温度,平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,所以,容器内NO2的体积分数在t3~t4时最大,故d错误;
故选:b;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K=4.375,K减小,说明升高了温度,平衡逆向移动,故答案为:升高温度.
③9.2gNO2的物质的量=
| 9.2 |
| 46 |
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为
| 0.1mol |
| 5-4 |
点评:本题考查范围广、考查知识点跨度大,包含了转化率、热化学方程式书写、弱电解质的电离平衡常数、燃料电池电极反应式书写、影响化学反应速率和平衡移动的条件、温度是影响化学平衡常数的唯一因素、离子方程式书写等等,题目难度较大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列变化中,需加入适当氧化剂才能完成的是( )
| A、CuO→Cu |
| B、KCl→AgCl |
| C、Fe→FeCl3 |
| D、HNO3→NO |
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此判断在100kPa压强下,下列结论正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、1mol石墨比1mol金刚石的总能量高 |
| D、1mol石墨比1mol金刚石的总能量低 |
能正确表示下列反应的离子方程式是( )
| A、FeO溶于足量稀HNO3:FeO+2H+═Fe2++H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |