题目内容
能正确表示下列反应的离子方程式是( )
| A、FeO溶于足量稀HNO3:FeO+2H+═Fe2++H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.发生氧化还原反应生成硝酸铁、NO和水;
B.NH4HCO3完全反应,生成碳酸钡、水、一水合氨;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合,反应生成碳酸钡、水、KOH;
D.等体积混合,物质的量比为1:2,反应生成硫酸钡、氢氧化铝和一水合氨.
B.NH4HCO3完全反应,生成碳酸钡、水、一水合氨;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合,反应生成碳酸钡、水、KOH;
D.等体积混合,物质的量比为1:2,反应生成硫酸钡、氢氧化铝和一水合氨.
解答:
解:A.FeO溶于足量稀HNO3的离子反应为3FeO+NO3-+10H+═3Fe3++NO↑+5H2O,故A错误;
B.NH4HCO3溶液与足量Ba(OH)2溶液混合的离子反应为NH4++HCO3-+Ba2++2OH-═BaCO3↓+H2O+NH3.H2O,故B错误;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合的离子反应为HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D错误;
故选C.
B.NH4HCO3溶液与足量Ba(OH)2溶液混合的离子反应为NH4++HCO3-+Ba2++2OH-═BaCO3↓+H2O+NH3.H2O,故B错误;
C.等物质的量的KHCO3和Ba(OH)2的溶液混合的离子反应为HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.将0.2mol/L的NH4Al(SO4)2溶液与0.4mol/L的Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度中等.

练习册系列答案
相关题目
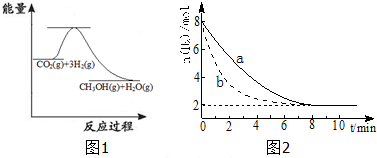
反应A(g)+2B(g)═C(g)的反应过程中能量变化如图所示.下列相关说法正确的是( )


| A、该反应是吸热反应 |
| B、催化剂改变了该反应的焓变 |
| C、曲线b表示使用催化剂后的能量变化 |
| D、该反应的焓变△H=-510kJ?mol-1 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、1mol醛基中含有电子的数目为16NA |
| B、1L pH=1的水溶液中含氢离子数目为NA |
| C、每生成1mol O2,电子转移数目一定是4NA |
| D、30g二氧化硅晶体中含共价键的数目为2NA |
下列说法正确的是( )
| A、0.1 mol/L的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3?H2O ④CH3COONH4中c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、NaHCO3溶液和Na2CO3溶液混合一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、25℃时,pH=11的氨水和pH=3的硫酸等体积混合:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| D、室温下,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液至中性,混合溶液中各离子浓度大小关系:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
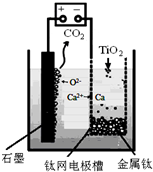 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,不正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,不正确的是( )| A、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| B、阳极的电极反应式为:C+2O2--4e-═CO2↑ |
| C、若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
| D、在制备金属钛前后,整套装置中CaO的总量不变 |
 科研、生产中常涉及钠、硫及其化合物.如图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述错误的是( )
科研、生产中常涉及钠、硫及其化合物.如图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述错误的是( )| A、该电池的负极材料是钠 |
| B、陶瓷材料的作用是导电(电解质)兼隔膜 |
| C、当电池中转移1.204×1024个电子时,消耗钠的物质的量为2mol |
| D、外电路中电子的移动方向是:S→Na |
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、由W元素形成的单质以及W与Z两元素形成的化合物都是原子晶体 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |