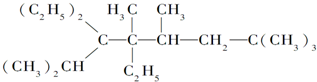
题目内容
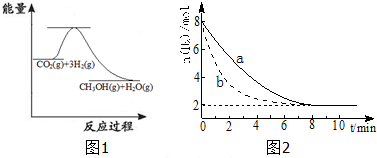
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此判断在100kPa压强下,下列结论正确的是( )
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、1mol石墨比1mol金刚石的总能量高 |
| D、1mol石墨比1mol金刚石的总能量低 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:物质具有的能量越低越稳定,且△H=生成物的能量和-反应物的能量和,△H>0时,反应吸热,据此分析.
解答:
解:物质具有的能量越低越稳定,且△H=生成物的能量和-反应物的能量和,1mol石墨转化为金刚石,要吸收1.895KJ的热能.
A、金刚石比石墨能量高,石墨稳定,故A正确;
B、金刚石比石墨能量高,石墨稳定,故B错误;
C、1mol石墨转化为金刚石,要吸收1.895KJ的热能,金刚石能量高,故C错误;
D、1mol石墨转化为金刚石,要吸收1.895KJ的热能,金刚石能量高,故D正确.
故选:AD.
A、金刚石比石墨能量高,石墨稳定,故A正确;
B、金刚石比石墨能量高,石墨稳定,故B错误;
C、1mol石墨转化为金刚石,要吸收1.895KJ的热能,金刚石能量高,故C错误;
D、1mol石墨转化为金刚石,要吸收1.895KJ的热能,金刚石能量高,故D正确.
故选:AD.
点评:本题主要考查物质具有的能量越低越稳定,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某无色溶液中只可能溶有NH4+、K+、Al3+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子.为分析其组成,现进行如下实验:
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
①取10mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲.
②取上述反应后的滤液,加入AgNO3溶液未见沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
则下列说法正确的是( )
| A、仅由实验①可推出肯定含有SO42-,不含Cl- |
| B、该无色溶液肯定含有NH4+、K+、Al3+、SO42- |
| C、该无色溶液肯定不含K+、Mg2+、HCO3-、Cl-、MnO4-、I- |
| D、不能确定该无色溶液是否含有K+ |
下列用来表示物质变化的化学用语中,正确的是( )
| A、明矾水解的离子方程式:Al3++3H2O?Al(OH)3↓+3H+ | ||||
| B、电镀时,要在铁上镀银,则正极为银,电极反应式为:Ag++e-═Ag | ||||
C、以石墨作电极电解氯化镁溶液:2Cl-+2H2O
| ||||
D、表示氢气燃烧热的化学方程式:H2(g)+
|
下列反应的离子方程式书写正确的是( )
| A、少量SO2气体通入到NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B、把Fe(OH)3溶于氢氟酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| D、在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O-+CO2+H2O═C6H5OH+HCO3- |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质,已知,它们可以发生如下反应:甲+乙→丁+己,甲+丙→戊+己;0.1mol/L丁溶液的pH为13(25℃).它们满足如图转化关系,下列说法正确的是( )
| A、Z元素在周期表中的位置为二周期第ⅥA族 |
| B、原子半径:W>Z>Y>X |
| C、1mol甲与足量的乙完全反应共转移了2mol电子 |
| D、1L 0.1mol/L戊溶液中阴离子总的物质的量小于0.1mol |
X、Y、Z、R、W是五种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期.下列说法错误的是( )
| A、原子半径:Z>R>W |
| B、气态氢化物稳定性:HW>H2R |
| C、XW4分子中各原子均满足8电子结构 |
| D、Y、Z、R三种元素组成的化合物水溶液一定显碱性 |