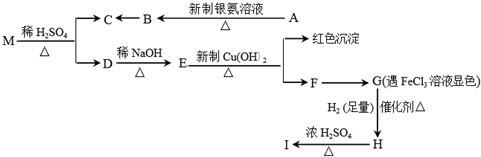
题目内容
某有机物A是一种重要中间体.
(1)已知有机物A的相对分子质量不超过180,若将A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,反应中消耗的O2和生成的CO2的物质的量相等,有机物A的分子式为 .根据有机物A能与NaHCO3反应放出气体,可知A分子中含有的官能团的名称是 .
(2)已知碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在.有机物A分子中有四个相邻的取代基,C分子的碳环上的一氯取代物只有两种结构.则B的结构简式为 .
(3)写出下列反应的化学方程式.C→D: .
(4)C的同分异构体中,含有三个取代基且碳环上的一氯取代物只有两种结构的异构体共有 种.

(1)已知有机物A的相对分子质量不超过180,若将A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,反应中消耗的O2和生成的CO2的物质的量相等,有机物A的分子式为
(2)已知碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在.有机物A分子中有四个相邻的取代基,C分子的碳环上的一氯取代物只有两种结构.则B的结构简式为
(3)写出下列反应的化学方程式.C→D:
(4)C的同分异构体中,含有三个取代基且碳环上的一氯取代物只有两种结构的异构体共有
考点:有机物的推断
专题:有机物的化学性质及推断
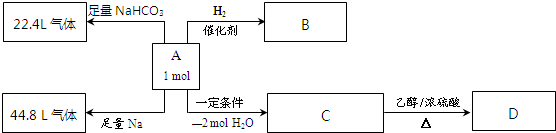
分析:A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,所以C和H的个数之比是7:10,又因为A分子的相对分子质量不超过180,A分子中有7个C原子、10个H原子,由于消耗的O2和生成的CO2的物质的量相等,即1molA消耗氧气7mol,有机物为A为C7H10O5,1molA能与NaHCO3反应放出22.4L气体,则A分子中含有1个-COOH,1molA能与足量的反应放出44.8L气体,即氢气物质的量为
=2mol,则A分子中还含有3个-OH,A分子饱和度=
=3,A脱去2分子水生成C,C分子的碳环上的一氯取代物只有两种结构,而A与氢气发生加成反应,可推知A中含有1个环、1个碳碳双键,碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在,且有机物A分子中有四个相邻的取代基,可推知A为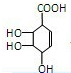 ,顺推可知B为
,顺推可知B为 ,C为
,C为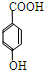 ,D为
,D为 ,据此解答.
,据此解答.
| 44.8L |
| 22.4L/mol |
| 2×7+2-10 |
| 2 |
 ,顺推可知B为
,顺推可知B为 ,C为
,C为 ,D为
,D为 ,据此解答.
,据此解答.解答:
解:(1)A完全燃烧,只生成CO2和H2O,且n(CO2):n(H2O)=7:5,所以C和H的个数之比是7:10,又因为A分子的相对分子质量不超过180,A分子中有7个C原子、10个H原子,由于消耗的O2和生成的CO2的物质的量相等,即1molA消耗氧气7mol,有机物为A为C7H10O5,
故答案为:C7H10O5;
(2)能与NaHCO3反应放出气体的是羧酸类物质,所以A分子中含有的官能团是羧基,
故答案为:羧基;
(3)1molA能与NaHCO3反应放出22.4L气体,则A分子中含有1个-COOH,1molA能与足量的反应放出44.8L气体,即氢气物质的量为
=2mol,则A分子中还含有3个-OH,A分子饱和度=
=3,A脱去2分子水生成C,C分子的碳环上的一氯取代物只有两种结构,而A与氢气发生加成反应,可推知A中含有1个环、1个碳碳双键,碳碳双键上接羟基时,或者一个碳原子上同时连接2个或2个以上羟基时不能稳定存在,且有机物A分子中有四个相邻的取代基,可推知A为 ,顺推可知B为
,顺推可知B为 ,
,
故答案为: ;
;
(3)A脱去2分子水生成C为 ,C与乙醇发生酯化反应生成D为
,C与乙醇发生酯化反应生成D为 ,反应方程式为:
,反应方程式为: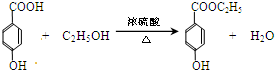 ,
,
故答案为: ;
;
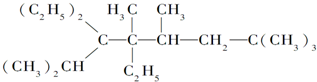
(4)C为 ,其同分异构体中,含有三个取代基,可以将羧基化为醛基和羟基,且碳环上的一氯取代物只有两种结构,符合条件的同分异构体有:
,其同分异构体中,含有三个取代基,可以将羧基化为醛基和羟基,且碳环上的一氯取代物只有两种结构,符合条件的同分异构体有: ,
,
故答案为:2.
故答案为:C7H10O5;
(2)能与NaHCO3反应放出气体的是羧酸类物质,所以A分子中含有的官能团是羧基,
故答案为:羧基;
(3)1molA能与NaHCO3反应放出22.4L气体,则A分子中含有1个-COOH,1molA能与足量的反应放出44.8L气体,即氢气物质的量为
| 44.8L |
| 22.4L/mol |
| 2×7+2-10 |
| 2 |
 ,顺推可知B为
,顺推可知B为 ,
,故答案为:
 ;
;(3)A脱去2分子水生成C为
 ,C与乙醇发生酯化反应生成D为
,C与乙醇发生酯化反应生成D为 ,反应方程式为:
,反应方程式为: ,
,故答案为:
 ;
;(4)C为
 ,其同分异构体中,含有三个取代基,可以将羧基化为醛基和羟基,且碳环上的一氯取代物只有两种结构,符合条件的同分异构体有:
,其同分异构体中,含有三个取代基,可以将羧基化为醛基和羟基,且碳环上的一氯取代物只有两种结构,符合条件的同分异构体有: ,
,故答案为:2.
点评:本题考查有机物的推断,综合分析确定A的结构是关键,较好的考查学生分析推理能力,注意掌握官能团的性质与转化,难度中等.

练习册系列答案
相关题目
下列变化中,属于物理变化的是( )
A、 火箭发射 |
B、 煤的燃烧 |
C、 风力发电 |
D、 酸雨侵蚀 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质,已知,它们可以发生如下反应:甲+乙→丁+己,甲+丙→戊+己;0.1mol/L丁溶液的pH为13(25℃).它们满足如图转化关系,下列说法正确的是( )
| A、Z元素在周期表中的位置为二周期第ⅥA族 |
| B、原子半径:W>Z>Y>X |
| C、1mol甲与足量的乙完全反应共转移了2mol电子 |
| D、1L 0.1mol/L戊溶液中阴离子总的物质的量小于0.1mol |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、1mol醛基中含有电子的数目为16NA |
| B、1L pH=1的水溶液中含氢离子数目为NA |
| C、每生成1mol O2,电子转移数目一定是4NA |
| D、30g二氧化硅晶体中含共价键的数目为2NA |
 汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
 A、B、C、D是中学化学常见的四种物质,它们的转化关系为:A+B═C+D
A、B、C、D是中学化学常见的四种物质,它们的转化关系为:A+B═C+D