题目内容
4.氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、医药、电键有机合成等行业.以工业海绵铜(主要成分是CuO和Cu)为原料,采用硝酸铵氧化分解技术生产硫酸铜进而生产氯化亚铜,生产工艺流程图如下: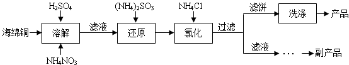
已知还原、氯化步骤发生的反应为:
2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4
思考并回答下列问题.
(1)溶解时生成的还原产物在酸性溶液中稳定存在,请写出此时的氧化还原反应离子方程4Cu+10H++NO3-=4Cu2++NH4++3H2O
(2)该工艺得到的副产品的化学式为(NH4)2SO4
(3)产品的洗涤方法是先用pH=2的稀H2SO4洗,后用95%的酒精洗,请设计简单实验方案,检验稀H2SO4洗时是否能洗干净:取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净.
分析 海绵铜加入硫酸和硝酸铵溶解得到溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜加入氯化铵氯化发生反应2CuSO4+(NH4)2SO3+2NH4Cl+H2O=2CuCl↓+2(NH4)2SO4+H2SO4,过滤得到固体为CuCl,滤液主要是硫酸铵和硫酸;
(1)溶解时生成的还原产物在酸性溶液中稳定存在,铜在硝酸铵和硫酸溶液中被硝酸氧化生成铜离子,硝酸根离子被还原为铵根离子;
(2)上述分析可知滤液主要是硫酸铵和硫酸,得到副产品为硫酸铵;
(3)得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,检验稀H2SO4洗时是否能洗干净,是取最后一次洗涤液检验是否含有硫酸铵,检验铵根的存在设计实验检验.
解答 解:(1)铜在硝酸铵和硫酸溶液中被硝酸氧化生成铜离子,硝酸钡还原为铵根离子,此时的氧化还原反应离子方程为4Cu+10H++NO3-=4Cu2++NH4++3H2O,
故答案为:4Cu+10H++NO3-=4Cu2++NH4++3H2O;
(2)上述分析可知滤液主要是硫酸铵和硫酸,得到副产品为硫酸铵,
故答案为:(NH4)2SO4;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,产品的洗涤方法是先用pH=2的稀H2SO4洗,后用95%的酒精洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,检验稀H2SO4洗时是否能洗干净,可以取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净;
故答案为:取最后一次洗涤液于试管中,加入氢氧化钠固体并加热,产生使湿润的红色石蕊试纸变蓝色的气体,则样品未洗涤干净,否则洗涤干净.
点评 本题考查了铜及其化合物性质的理解应用,主要是物质性质和反应产物的判断,掌握基础是关键,题目难度中等.

| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
| A. | 绝对不溶解的物质是不存在的 | |
| B. | 不溶于水的物质其溶解度为零 | |
| C. | 某离子被沉淀完全,则该离子在溶液中的浓度为零 | |
| D. | 物质的溶解性为难溶,则该物质不溶于水 |
| A. | 降低体系温度 | B. | 增大体系容积 | C. | 移去SO3 | D. | 通入O2 |
 铜是应用广泛的有色金属.
铜是应用广泛的有色金属.