题目内容
9. 铜是应用广泛的有色金属.
铜是应用广泛的有色金属.(1)基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1.
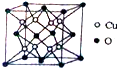
(2)铜与氧形成化合物的晶体结构如图.该化合物的化学式为Cu2O,O的配位数是8.晶胞结构为正方体,边长为apm,则晶体的密度为$\frac{5.76×1{0}^{32}}{{N}_{A}{a}^{3}}$g/cm-3(用含NA、a的代数式表示).
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,利用均摊法计算晶胞中Cu原子、O原子数目,进而确定晶体的化学式;以上底面面心O原子研究,与之最近的Cu原子有8个,为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子;根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,晶胞中Cu原子数目为8、O原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶体的化学式为Cu2O;以上底面面心O原子研究,与之最近的Cu原子为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子,O原子配位数为8,晶胞中Cu原子数目为8、O原子数目为4,晶胞体积V=(a×10-10cm)3,则ρ=$\frac{m}{V}$=$\frac{(8×64+4×16)}{\frac{{N}_{A}}{(a×1{0}^{-10})^{3}}}$=
故答案为:Cu2O;8;$\frac{5.76×1{0}^{32}}{{N}_{A}×{a}^{3}}$.
点评 本题是对物质结构的考查,涉及核外电子排布晶胞计算等,需要学生具备扎实的基础,难点是晶胞的计算,注意pm与cm之间的进制,为易错点,题目难度中等.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
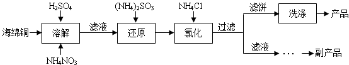
20.海水中蕴藏着丰富的资源.海水综合利用的流程图如图.
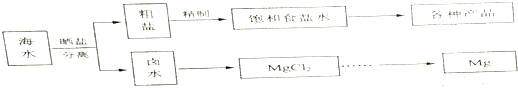
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.

(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
14.一个实验桌上放着四瓶化学药品,标签上分别写着蔗糖、淀粉、氯化钠、食用味精.为研究这些物质的性质,下列说法中不可取的是( )
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
1.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 金属元素和非金属之间只存在离子键 | |
| B. | 共价化合物里,一定存在极性键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 在离子化合物不可能存在非极性共价键 |
15.为充分利用海洋资源,美国斯坦福大学研究人员发明了“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列有关“水”电池在海水中放电时的说法正确的是( )
| A. | 负极反应式:Ag+Cl-+e-═AgCl | |
| B. | Na+不断向“水”电池的正极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
16.分子式为C3H6O3的有机物,在一定条件下具有下列性质:①在浓硫酸作用下,能分别与C2H5OH和CH3COOH反应;②在浓硫酸作用下,能生成一种分子式为C6H8O4的六元环状化合物.据此,可确定C3H6O3有机物的结构简式为( )
| A. | HOCH2CH2COOH | B. | CH3CH(OH)COOH | C. | CH3OCH2COOH | D. | CH3CH(OH)CH2COOH |
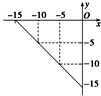 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.