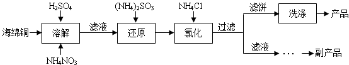
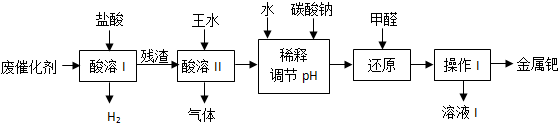
题目内容
16.已知3Cu+8HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu(NO3)2+2NO↑+4H2O,现反应生成4.48LNO(标准状况下),求.(1)消耗Cu的质量.
(2)若反应溶液的体积为150mL,求生成的Cu(NO3)2的物质的量浓度.
(3)被还原的HNO3的物质的量.
分析 (1)根据n(NO)=$\frac{V}{{V}_{m}}$结合反应的化学方程式进行计算;
(2)根据c=$\frac{n}{V}$计算求解;
(3)被还原的HNO3的物质的量等于生成一氧化氮的物质的量.
解答 解:(1)n(NO)=$\frac{V}{{V}_{m}}$=$\frac{4.48L}{22.4L/mol}$=0.2mol,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 2mol
n(Cu) 0.2mol
消耗Cu,n(Cu)=0.2mol×$\frac{3}{2}$×64g/mol=19.2g,
答:加入的铜的质量为19.2g;
(2)Cu(NO3)2的物质的量等于铜的物质的量,所以Cu(NO3)2的物质的量为0.3mol,根据c=$\frac{n}{V}$=$\frac{0.3mol}{0.15L}$=2mol/L,答:Cu(NO3)2的物质的量浓度为2mol/L;
(3)被还原的HNO3的物质的量等于生成一氧化氮的物质的量,所以物质的量为0.2mol,答:被还原的HNO3的物质的量为0.2mol.
点评 本题考查硝酸的性质,侧重于学生的分析能力和计算能力的考查,为高频考点,难度中等,注意结合反应的化学方程式从氧化还原反应实质解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.选择正确答案的序号,填入下表空格中.
A、同位素 B、同分异构体 C、同系物 D、同素异形体 E、同一物质 F、同类物质
A、同位素 B、同分异构体 C、同系物 D、同素异形体 E、同一物质 F、同类物质
| 物质名称 | 相互关系 | 物质名称 | 相互关系 |
| ①氯仿与三氯甲烷 | ④氕、氘、氚 | ||
| ②一氯甲烷与四氯化碳 | ⑤白磷与红磷 | ||
| ③乙烷与新戊烷 | ⑥正丁烷与异丁烷 |
1.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 金属元素和非金属之间只存在离子键 | |
| B. | 共价化合物里,一定存在极性键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 在离子化合物不可能存在非极性共价键 |
2.为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | CH4(C2H4) | 酸性高锰酸钾 | 洗气 |
| D | 硝基苯(硝酸) | 氢氧化钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
3.下列化学用语表示正确的是( )
| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图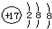 | ||
| C. | 氯化钠的电子式是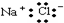 | D. | 乙酸与乙醇互为同分异构体 |
 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
 、
、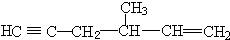 .
. 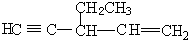 .
.