题目内容
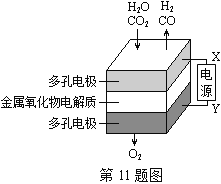
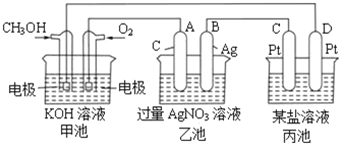
【题目】如图是一个化学过程的示意图,回答下列问题:
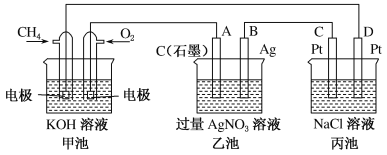
(1)甲池是_____装置,乙装置中电极A的名称是______。
(2)甲装置中通入CH4的电极反应式为_____,乙装置中电极B(Ag)的电极反应式为_____,丙装置中D极的产物是_____(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=_____。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入_______(写名称)。
【答案】原电池 阳极 CH4+10OH--8e-= CO32-+7H2O Ag++e-=Ag H2和NaOH 12 HCl气体
【解析】
(1)甲池为甲烷形成的燃料电池;根据原电池的正负极判断电解池的阴阳极;
(2)CH4在负极上失电子,碱性条件下生成CO32-;乙装置中B(Ag)的电极为阳离子得电子;丙装置中D为阴极;
(3)电解氯化钠溶液时,阴极上H+放电,阳极上Cl-放电,根据方程式确定氢氧化钠的物质的量浓度,从而求出溶液的pH;再根据电解的产物分析加入的物质。
(1)甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,为阳极;
(2)CH4在负极上失电子,碱性条件下生成CO32-,因此通入CH4的电极反应式为CH4+10OH--8e-= CO32-+7H2O;乙装置中B(Ag)的电极为阳离子得电子,电极反应为Ag++e-=Ag;丙装置中D为阴极,电极上水放电生成H2和OH-,因此D极的产物是H2和NaOH;
(3)丙池中产生112 mL气体,那么生成的H2和Cl2的体积各为56ml,因此生成氢氧化钠的物质的量为0.005mol,c(OH-)=![]() =0.01mol/L,那么c(H+)=
=0.01mol/L,那么c(H+)=![]() mol/L=10-12mol/L,因此溶液的pH=12;由于电解生成H2和Cl2,所以应该加入的物质为HCl。
mol/L=10-12mol/L,因此溶液的pH=12;由于电解生成H2和Cl2,所以应该加入的物质为HCl。

 阅读快车系列答案
阅读快车系列答案【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |
(1)盐酸的物质的量浓度为_____。
(2)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_____(填“偏高”或“偏低”或“无影响”)。
(3)下列有关实验的说法正确的是______。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=_________。