题目内容
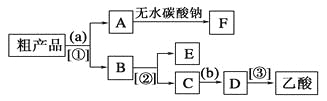
【题目】(一)下图是一种工业制取纯碱的生产流程简图:

(1)饱和食盐水中先通![]() 后通
后通![]() 的原因是___________。
的原因是___________。
(2)生成沉淀A的化学方程式为_____;将石灰乳加入滤液B中发生反应的化学方程式为_______。
(3)流程甲中可循环利用的物质的名称为________。
(二)某化工厂对流程甲进行了如图所示的改进。

(4)流程乙中可以循环利用物质的化学式为____;和流程甲相比,流程乙的优点是____。
(5)不用其他试剂,检验流程乙中副产品F是否纯净的操作是_____________。
(6)在流程乙中,若使用11.7 t食盐,最终得到10.07 t纯碱,则NaCl的利用率为_____。
【答案】氨在水中溶解度大,先通氨,可以吸收更多的二氧化碳,提高生成![]() 的浓度,有利于促进更多的
的浓度,有利于促进更多的![]() 析出
析出 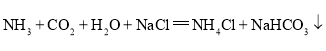
![]() 二氧化碳和氨
二氧化碳和氨 ![]() ,NaCl 提高氯化钠的利用率,同时得到的
,NaCl 提高氯化钠的利用率,同时得到的![]() 可作氮肥、减少环境污染 取少量氯化铵产品于试管中,加热,若试管中无残留物,表明氯化铵产品纯净 95%
可作氮肥、减少环境污染 取少量氯化铵产品于试管中,加热,若试管中无残留物,表明氯化铵产品纯净 95%
【解析】
(1)饱和食盐水中先通NH3后通CO2,是因为氨在水中溶解度大,先通氨,可以吸收更多的二氧化碳,提高生成HCO3-的浓度,有利于更多的NaHCO3析出;
(2)沉淀A为NaHCO3,生成NaHCO3的反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓。滤液B的溶质主要为NH4Cl,加入石灰乳,发生反应:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)根据图示,流程甲中可循环利用的物质为二氧化碳和氨。
(4)根据图示,流程乙中可以循环利用的物质为CO2、NaCl。流程乙的优点是提高氯化钠的利用率,同时得到的NH4Cl可作氮肥、减少环境污染;
(5)F为NH4Cl,检验NH4Cl是否纯净,可取少量氯化铵产品于试管中,加热,若试管中无残留物,表明氯化铵产品纯净。
(6)根据关系式:2NaCl~~~ Na2CO3,使用11.7 t食盐,理论上得到纯碱的质量为10.6 t,故NaCl的利用率为![]() 。
。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是_____________________________(至少一条)
(2)调pH=4.0是为了除去______________________(填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn++ n NaR → MRn+nNa+,被交换的杂质离子是___________________________(填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4