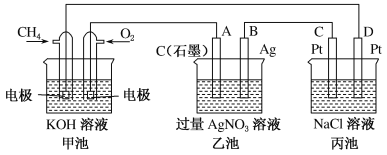
题目内容
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |
(1)盐酸的物质的量浓度为_____。
(2)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_____(填“偏高”或“偏低”或“无影响”)。
(3)下列有关实验的说法正确的是______。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=_________。
【答案】0.10 mol·L-1 偏高 CD 8
【解析】
(1)由所给数据可知,三组数据均有效,消耗氢氧化钠的平均体积为![]() mL=20.00ml,因此c(酸)=
mL=20.00ml,因此c(酸)=![]() =
=![]() =0.10mol/L;
=0.10mol/L;
(2)滴定管尖嘴处有气泡,使得标准液的消耗体积变大,导致测定的结果偏高;
(3)A. 中和热的测定实验中,需要测定酸和碱的温度以及反应过程中的最高温度,每完成一次实验至少要读取三次温度,A项错误;
B. 新制的氯水中含有次氯酸,具有漂白性,能够漂白pH试纸,因此不能用pH试纸测定新制氯水的pH,B项错误;
C. 中和滴定的过程中,锥形瓶中有少量的蒸馏水,对结果没有影响,因此洗净后的锥形瓶不需要干燥,C项正确;
D. 醋酸钠为强碱弱酸盐,水溶液呈碱性,因此向CH3COONa溶液中滴入石蕊试液,溶液变蓝,D项正确;
E. 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明CuS更难溶,溶度积更小,因此Ksp(ZnS)>Ksp(CuS),E项错误;
答案选CD;
(4)pH=5的盐酸中c(H+)=10-5mol/L,pH=9盐酸中c(OH-)=10-5mol/L,按体积比为9:11混合,反应中NaOH过量,反应后c(OH-)=![]() =10-6mol/L,c(H+)=
=10-6mol/L,c(H+)=![]() mol/L=10-8mol/L,因此溶液的pH为8。
mol/L=10-8mol/L,因此溶液的pH为8。

【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
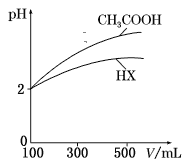
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
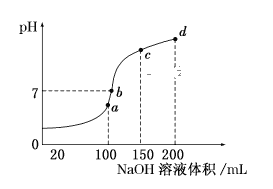
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。